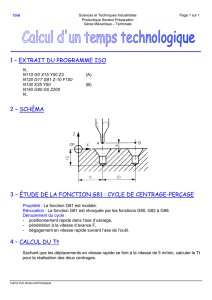
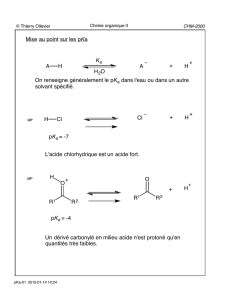
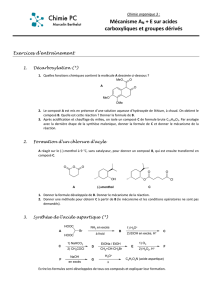
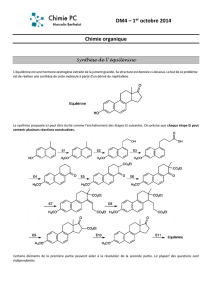
4) Réactions des énolates avec des dérivés carbonylés (suite

© Thierry Ollevier CHM-2000
Chimie organique II
4) Réactions des énolates avec des dérivés carbonylés (suite)
Condensation de Claisen
CH3O
O
O
O
Mécanisme
NaOEt
CH3O
O
CH3O
O O
+
= réaction de l'énolate d'un ester avec un composé carbonylé
OCH2CH3
H
H
H
O
O
H
H
O
O
H
H
HOCH2CH3
+
formation de l'énolate de l'ester
O
O
H
H
H
O
O
H
H
+
CH2
H
H
H
O O O
OEt
addition
nucléophile
- EtOH
enolates-41 2017-01-06 16:11

© Thierry Ollevier CHM-2000
Chimie organique II
Mécanisme (suite)
enolates-42 2017-01-06 16:11

© Thierry Ollevier CHM-2000
Chimie organique II
Exemple
O
O O
O
ONaOCH2CH3
HOCH2CH3
2
O
O
OCH2CH3
H
H3C
H
O
O
H3C
H
HOCH2CH3
+
O
O
H
H3C
H
O
O
H3C
H
O
O O
OCH2CH3
O
O O
H+
O
O O
enolates-43 2017-01-06 16:12

© Thierry Ollevier CHM-2000
Chimie organique II
Exercices
O
O
O
O
Donnez les produits qui résulteront de la condensation de Claisen
dans le cas 1) du 3-méthylbutanoate d'éthyle, 2) du pentanoate d'éthyle.
Pour chacune des réactions, la base est l'éthanolate de sodium et le
solvant est l'éthanol.
1)
2)
O
O
1)
NaOCH2CH3
HOCH2CH3
?
NaOCH2CH3
HOCH2CH3
?
Solutions
O
2)
O
O O
enolates-44 2017-01-06 16:12

© Thierry Ollevier CHM-2000
Chimie organique II
Condensation de Claisen mixte (avec deux esters différents)
= réaction de l'énolate d'un ester avec autre ester (un des esters n'a pas
d'hydrogène en α
OEt
O
OEt
O1) CH3CH2ONa,
CH3CH2OH
2) H3O+
O O
OEt
+
Problème 19.1 (S)
☞
Problème 19.3 (S)
☞
Problème 19.4 (S)
☞
Condensation de Claisen mixte (entre une cétone et un ester)
OEt
O O O O
+
1) NaH
2) H3O+
La cétone est plus acide que l'ester. Elle est donc convertie en énolate
avant l'autocondensation de l'ester sur lui-même.
enolates-45 2017-01-06 16:12
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
1
/
20
100%