Synthese d`un ester

Chapitre IV Substances aromatiques –Savons Leçon I Synthèse d’un ester
Chapitre IV : SUBSTANCES AROMATIQUES ET SAVONS
Leçon I. Synthèse d’un ester utilise en parfumerie
Ex1.
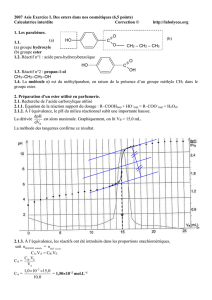
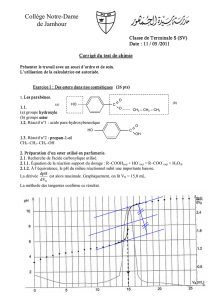
Une masse m =5,8 g d’un ester à odeur fruitée est traitée à chaud (sous reflux) par V= 9,0 mL
d’une solution d’acide sulfurique à 1,0 mol.L-1. Après 10h, l’équilibre est atteint ; le mélange
réactionnel est refroidi puis dosé à l’aide d’une solution de soude à Co= 4,0mol.L-1 en
présence de phénol-phtaléïne. Le volume versé à l’équivalence estVe=13,9 mL.
1. Sachant que, dans une solution d’acide sulfurique de concentration C, [H3O+]=2C,
déterminer le volume Vo de soude de concentration Co qui permet de doser 9,0 mL d’acide
sulfurique à 1,0 mol.L-1.
2. Déterminer la quantité d’acide carboxylique formé à l’équilibre.
3. 75,4% de l’ester a été hydrolysé ; en déduire sa masse molaire, puis sa formule brute
sachant qu’il ne présente ni cycle ni insaturation.
4. Cet ester comporte le même nombre d’atomes de carbone dans ses deux chaînes ;
quelles formules développées peut-on lui attribuer ?
_______________________________
1. Volume de soude nécessaire au dosage
A l'équivalence, la quantité d'ions HO- versée est égale à la quantité d'ions H3O+ initialement
présente dans la solution acide : n(HO-) = n(H3O+) ou C0V0 = 2CV
49x1x2
VV
C
C2
V0
0
0== C et C0 en mol.L-1, V en mL et V0 en mL
V0 = 4,5 mL
2.Quantité d’acide carboxylique à l’équilibre
Cette réaction est une réaction d'hydrolyse et l'acide sulfurique joue le rôle de catalyseur :
ester + eau acide + alcool
Au cours du dosage réalisé à l'équilibre, tous les ions H3O+ présents dans la solution, nt,
réagissent : les ions présents initialement ni = 2CV et les ions formés au cours de la réaction
d'hydrolyse nf.
nt = ni + nf nf = nt - ni
A l'équivalence nt = n(OH-) = C0Ve n
f = C0Ve – 2CV
nf = (4x13,9 – 2x1x9)10-3 C et C0 en mol.L-1 et V et V0 en L
nf = 3,76.10-2mol quantité d'acide formé au cours de la réaction d'hydrolyse.
3. Masse molaire de l’ester
Si la réaction d'hydrolyse est totale, 1 mol d'ester donne 1 mol d'acide. Ici, on a obtenu
0,754mol d'acide pour 1mol d'ester.
Pour obtenir nf d'acide, il a fallu hydrolyser une quantité ned'ester : 754,0 n
nf
e= de masse m
Masse molaire de l'ester : en
m
M= fn
m754,0
M= m = 5,8 g
2
10.76,3
8,5x754,0
M−
= M = 116 g.mol-1
72

Chapitre IV Substances aromatiques –Savons Leçon I Synthèse d’un ester
Formule brute d'un ester non cyclique et saturé est CnH2nO2 ; M = 12n + 2n + (2x16) = 116
14 n + 32 = 116 14n = 116 – 32 14
84
n= n = 6
Formule brute de l'ester : C6H12O2
4. Formule semi développée : C2H5COOC3H7
isomères possibles : le propanoate de propyle
le propanoate d'isopropyle ou propanoate de méthyl-éthyle
CH3─CH2─C
O─CH2─CH2─CH3
O
CH3─CH2─C
O─CH─CH3
│
CH3
O
73

Chapitre IV Substances aromatiques –Savons Leçon I Synthèse d’un ester
Ex 2. Synthèse d’un ester à odeur de banane
1) On veut préparer un ester E à odeur de banane en faisant réagir du butan-1-ol avec
de l’acide éthanoïque, ou avec de l’anhydride éthanoïque.
a) En utilisant les formules semi-développées, écrire les équations-bilans de ces deux
réactions. Nommer l’ester formé.
b) Préciser les différences entre ces deux réactions.
2) On fait réagir 0,100 mol d’anhydride éthanoïque avec 0,100 mol de butan-1-ol
a) Calculer le volume de butan-1-ol utilisé.
b) On obtient 9,9 mL d’ester E. Calculer le rendement de cette préparation, c'est-à-
dire le rapport de la quantité d’ester produit sur la quantité d’ester obtenue si la réaction était
totale.
Données :
M Masse molaire (g.mol-1) µ masse volumique (g.mL-1)
Butan-1-ol (B) 74 0,81
Ester E 116 0,88
________________________________
1) a) Préparation d’un ester E à partir du butan-1-ol et de l’acide éthanoïque :
CH3―(CH2)2―CH2OH + CH3―COOH CH3―COO― (CH2)3―CH3 + H2O (1)
Préparation d’un ester E à partir du butan-1-ol et de l’anhydride éthanoïque
CH3―(CH2)2 ─CH2OH + (CH3―CO)2O → CH3―COO―(CH2)3―CH3 + CH3―COOH (2)
« E » est l’éthanoate de butyle ou acétate de butyle
b) La 1ère réaction est une estérification. Elle n’est pas totale : elle aboutit à un
équilibre chimique
La 2ème réaction est totale.
2) a) Calcul du volume VB de butan-1-ol utilisé :
B
BV
m
µ= µ
B VB = m m = n MB et n = 0,1 mol
µB VB = 0,1MB
B
B
B
M1,0
Vµ
= MB = 74 g.mol-1 et µB = 0,88 g.mL-1
89,0
741,0
VB
×
= VB = 9,1 mL
b) Calcul du rendement de la réaction :
Nombre de mol nE d’ester obtenu :
E
EE
E
E
EM
V
M
m
nµ
== 116
9,988,0
nE
×
= nE = 7,5.10-2 mol
Si le rendement de la réaction (2) était de 100%, on obtiendrait 0,10 mol d’ester. En fait le
rendement est ici :
%75
1,0
075,0
Rdt ==
Remarque : il est toujours préférable d'utiliser un chlorure ou un anhydride d'acide pour une
estérification : le rendement est meilleur qu'avec un acide et la réaction rapide.
74

Chapitre IV Substances aromatiques –Savons Leçon I Synthèse d’un ester
Ex3. Fleur d’oranger :
L’anthranilate de méthyle a une odeur de fleur d’oranger. Il est utilisé dans la
fabrication d’arômes de jus de fruits. On le prépare par action de l’acide
anthranilique sur le méthanol.
formule de l’anthranilate de méthyle :
N
H2
COOCH3
1. Donner la formule de l’acide anthranilique.
2. La réaction étant réalisée en présence d’un excès de méthanol, on arrive à un
rendement de 90%. Quelle est la quantité d’acide anthranilique nécessaire à la
fabrication de 100 Kg de cet ester ?
____________________________
1 A partir de la formule de l’ester anthranilate de méthyle, on peut déduire la formule de
l’acide anthranilique
2. Equation bilan de la réaction d'estérification :
N
H2
COOH
N
H2
COOH
N
H2
COOCH3
CH3OH
+ + H2O
On veut préparer une masse me = 100kg d'ester. Si Me est la masse molaire de l'ester, la
quantité de matière correspondante est e
e
M
m
n=
e
D'après l'équation bilan, 1 mol d'acide donne 1mol d'ester quand la réaction est totale.
Pour un rendement de 90%, à partir d'une mol d'acide on obtient 0,9 mol d'ester.
Pour obtenir ne mol d'ester, il faut donc faire réagir une quantité d'acide na
e
e
a
e
aM9,0 m
n
9,0
n
n==
Si Ma est la masse molaire de l'acide anthranilique, il faut une masse d'acide ma :
ma = na.Ma e
ae
aM.9,0 M.m
m=
formule brute de l'anthranilate de méthyle : C8H9O2N ; Me = (8x12)+(9x1)+(2x16)+14
Me = 151 g.mol-1
Formule brute de l'acide anthranilique : C7H7O2N ; Ma = (7x12)+(7x1)+(2x16)+14
Ma = 137 g.mol-1
Application numérique : 151
137
x
9,0
100
ma= m
e en kg, Me et Ma en g.mol-1, ma en kg
ma = 100 kg
Pour obtenir 100kg d'anthranilate de méthyle, il faut faire réagir 100 kg d'acide
anthranilique.
75
1
/
4
100%