Prévention des infections nosocomiales par les Précaution

1
UE8 – De l’agent infectieux à l’hôte
Date : 30/01/2017 Plage horaire : 16h15-18h15
Promo : P2 2016-2017 Enseignant : Dr Lugagne
Ronéistes :
GAMBLIN Pierre-Louis
LEMEE Audrenn
Prévention des infections nosocomiales par les Précaution
Standards (PS) et Complémentaires d’Hygiène (PCH)
(Suite) : Prévention de la transmission croisée des M.O
I. Introduction
II. Précautions standards
1. Hygiène des mains
A. Les armes : Le SHA
B. Recommandations 2009
2. Port de gants
3. Port de surblouse, lunettes, masque
A. Port de surblouse
B. Port de lunettes
C. Port du masque chirurgical
4. Gestion du matériel
5. Surfaces souillées
6. Transport de prélèvement biologique, linge et matériel souillé
7. Accidents d’Exposition au Sang (AES)
III. Précautions Complémentaires d’Hygiène
1. Objectifs des PCH
2. Transmission par contact
3. Transmission par gouttelettes
4. Transmission par voie aérienne
5. Conclusion
6. Levée des PCH
IV. Cas particulier : Maîtrise de la diffusion des BHR
1. Alerte d’août 2010
2. Maitriser le phénomène
3. Les recommandations nationales
4. Fiche technique opérationnelle CTINILS, décembre 2006
5. Maîtrise de la diffusion des BHR
V. Conclusion

2
I. Et II. Sur l’autre ronéo.
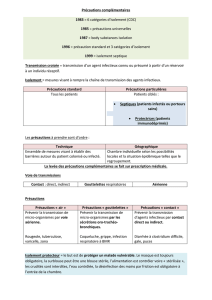
III. Les Précautions Complémentaires d’Hygiène
Pour certains patients. Lesquels ? Ceux qui sont contagieux. Ils nécessitent donc des précautions
complémentaires d’hygiène. Ici c’est juste une diapo pour comprendre la
différence entre les PCH (autrefois appelé
« isolement septique »), c’est-à-dire que vous avez
ici un patient avec des micro-organismes
transmissibles dont on ne veut pas qu’ils sortent de
la chambre, et à l’inverse l’isolement protecteur
mais qui ne sera pas traité dans ce cours, fréquent en
hémato-oncologie, avec des patients en état
d’immunodépression aiguë (chimiothérapie, sous
immunosuppresseurs, etc.) pour eux c’est donc
l’inverse : on les met dans une chambre pour
qu’aucun micro-organisme de l’extérieur ne rentre.
1. Objectifs des PCH
Éviter de façon renforcée la transmission croisée :
-À partir de l’environnement du malade : air – eau – surface.
-À partir du réservoir humain: personnel soignant, visiteurs, intervenant extérieur,…
Pour certains patients ciblés.
❖ Les indications :
- Patient atteint d’une infection transmissible contagieuse (tuberculose, rougeole, Ebola, gale)
- Patient infecté ou colonisé par un agent infectieux qui peut se disséminer, tout ce qui touche les
bactéries résistantes aux antibiotiques. Il est important de comprendre qu’une bactérie résistante aux
antibiotiques n’est pas une bactérie pathogène, c’est juste une bactérie qu’il est difficile de traiter.
C’est le retard à la mise en place d’une bactériothérapie efficace qui fera qu’il y aura un taux de
mortalité plus important lors de colonisation par BMR.
- Patient porteur d’une Bactérie Multi Résistante aux antibiotiques
(BMR)
Ici c’est la même diapo qu’au début, on veut que rien ne sorte.
❖ Evolution des recommandations :
❖ Comment les choisir ?
-Nature de l'agent infectieux
-Localisation de l’infection ou du portage
-Caractéristique des sujets à protéger
-Contexte de l’établissement ou du service

3
Nous avons vu les différents modes de transmission interhumains de micro-organismes : air, gouttelettes et
contact. Donc il y aussi 3 précautions complémentaires : précaution contact, précaution gouttelettes,
précaution air. On peut avoir l’association de différents mode de transmission comme la varicelle qui est
contagieuse par air et par contact par exemple donc il faudra faire attention à prendre des précautions
contact et aériennes. La rougeole comme la tuberculose, c’est air pur. La grippe aviaire comme Ebola : air
et contact. Ce qui fait qu’au final il y a plus que 3 précautions complémentaires (Oui tout ça pour ça..
2. Transmission par contact
❖ Mesures recommandées en 2009 :
- Hygiène des mains : désinfection des mains SHA à privilégier, les
indications habituelles d’hygiène des mains sont maintenues, après
contact avec le patient ou son environnement +++.
- Protection de la tenue : uniquement si soin impliquant un contact
direct avec le patient ou un contact important avec son environnement.
Port d’un tablier plastique ou d’une surblouse si soin étendu (surblouse
imperméable avec manches longues si toilette par exemple).
Même si l’on n’a pas de contact avec le sang ou les liquides
biologiques, on risque de contaminer la tenue car ce sont des germes qui
sont présentes dans le patient, sur le patient et dans son environnement.
- Chambre individuelle recommandée pour patient porteur de BMR. Ce n'est pas obligatoire car on
manque de chambres seules dans les hôpitaux et on ne peut pas toujours isoler le patient. Pour précautions
gouttelettes et air, il faut impérativement une chambre seul.
- Ou regroupement de plusieurs patients si strictement le même microorganisme.
- Privilégier le matériel à usage unique ou le matériel dédié à un patient. C’est l’exemple type du
stéthoscope qui reste dans la chambre. Cette fois le stéthoscope ne va pas devenir un vecteur de
transmission indirecte puisqu’il va rester dans la chambre du patient.
- Limiter les déplacements du patient. Le plus possible. Si le patient veut sortir SHA + surblouse.
- Visiteurs : hygiène des mains +++ avec SHA (pas de surblouse et limiter le nombre des visiteurs).
Dans le cas précis de la précaution contact, quand le visiteur va finir sa visite il aura probablement sur les
mains la bactérie qu'on cherche à contenir donc il faudra lui demander du refaire une hygiène des mains en
plus de celle qu'il a fait en arrivant. De plus il ne faut pas qu'il aille faire d'autres visites car il risque de
répandre la bactérie avec ses vêtements contaminés.
Question d'élève : Pourquoi on ne demande pas aux visiteurs de porter une surblouse ?
Réponse : Normalement un visiteur est censé faire une seule visite donc on ne lui demande pas de porter
une surblouse car à priori il n'est pas censé contaminer son vêtement. Même si cela arrive, quand il va
rentrer chez lui il ne va pas retrouver d'autres personnes susceptibles de développer des infections
nosocomiales donc même s'il a emporté un peu de BMR avec lui cela n'aura aucune conséquence.
Cependant le problème est que souvent les visiteurs vont voir plusieurs patients et là c'est problématique car
s'il emporte un peu de BMR sur ses vêtements entre 2 patients il risque de contaminer le 2e.
Question d'élève : Et pour la galle par exemple ?
Réponse : Pour la galle c'est très différent, les précautions complémentaires d'hygiène sont très
particulières. Dans ce cas-là le visiteur a une surblouse voire il n'y a pas de visite du tout c'est encore
mieux. En effet le patient qui a la galle, à partir du moment où il est traité, est contaminant pendant encore

4
48 heures donc idéalement on interdit les visites. Mais si jamais les visites sont autorisées et que le patient
est encore contaminant les patients doivent porter gants et surblouse.
❖ Mesures NON recommandées dans les précautions contact en 2009 :
- Port du masque : à porter dans le cadre des précautions standard. Le port du
masque n'est pas systématique pour la précaution contact, on le met que si cela
entre dans le cadre des précautions standards (patient/soignant qui tousse,…).
- Port de gants : responsable de fautes d’asepsie, car « gants de l’isolement » non
changés pour les différentes activités dans la chambre et oubli de les enlever à la
sortie de la chambre. Attention au gant vecteur de la transmission croisée. Le gant
n'est donc pas recommandé en précaution contact sauf dans le contexte des
précautions standard (si on est en contact avec liquide biologique, en dehors de ce
contexte, les gants sont dangereux pour les autres patients).
- Effectuer les soins en série, il faut s'occuper de chaque patient individuellement et faire tous les soins
d'un patient donné avant de passer à un autre.
- Stocker les matériels et consommables dans la chambre.
- Traitement spécifique pour la vaisselle et le linge, il n'y a pas de traitement spécifique de ce matériel
en précaution contact.
- Visiteurs : le port de surblouse (surchaussure, charlotte, etc.), on ne déguise pas les visiteurs, sauf
éventuellement en cancérologie (patients immunodéprimés).
3. Transmissions par gouttelettes
Voilà une liste de maladies transmissible par gouttelettes :
- Adénovirus (contact + gouttelette) (c’est les virus des rhumes humains par exemple)
- Oreillons
- Rubéoles
- Méningites à méningocoques
- Grippe saisonnière
- Coqueluche
- Pharyngite à Strepto A (infections de gorge)
- VRS (Le Virus Respiratoire syncytial que l’on voit pas mal en pédiatrie chez les nouveaux nés)
Précautions gouttelettes :
- Un isolement géographique (c-à-d une chambre individuelle), si on met dans la même chambre un
patient qui a la grippe et un qui ne l'a pas, ce dernier va l'attraper très vite car les gouttelettes
peuvent être envoyés jusqu'à 5m. Par contre on peut laisser la porte ouverte car les gouttelettes
tombent par terre et ne vont pas passer la porte pour aller dans les autres chambres.
- Le port du masque chirurgical avant d’entrer dans la chambre du patient, normalement la boîte de
masques doit être à l'extérieur de la chambre. Si le patient tousse on peut éventuellement lui
demander de porter un masque quand quelqu'un est dans la chambre.
- Limitation des déplacements du patient
- Déplacements du patient avec masque chirurgical

5
Affiche sur la porte des patients en précaution
gouttelettes
4. Transmission par voie aérienne
- Sécrétions respiratoires < 5 mm
- Suspension dans l’air
- Diffusion à distance de la source
- BK, rougeole, varicelle, grippe aviaire, lèpre lépromateuse…
❖ Les précautions air :
- Isolement en chambre individuelle, porte fermée
- Port de masque spécifique (respiratoire FFP2) dès entrée dans la chambre pour le personnel, boîte à
l'extérieur de la chambre.
- Limitation des déplacements du patient
- Port du masque chirurgical dès que le patient est en présence d’une tierce personne ou s'il doit se
déplacer. Pas de FFP2 pour un patient à transmission air car il a déjà beaucoup de mal à respirer et
il est difficile de respirer avec ce masque même pour le personnel.
Précaution AIR : cas particuliers
-Ebola : pas de transmission AIR…
-Cas du papillomavirus au bloc opératoire : risque infectieux lié aux fumées produites par le traitement
au laser des différentes lésions cutané muqueuses chez les patients (dermato, gynéco, ORL,
pédiatrie…).La protection est le FFP2 pour les soignants au bloc.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
1
/
11
100%