Petscan dans les TIPMP. - Club Francais du Pancreas

1
BRD 10/6-P
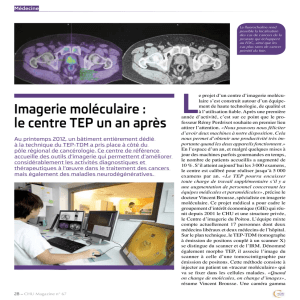
«Evaluation de la tomographie par émission de
positons au 18 fluoro-déoxy-glucose couplée au
scanner (TEP-TDM au 18FDG) dans le diagnostic
de dégénérescence des tumeurs intra-canalaires
papillaires et mucineuses du pancréas (TIPMP)»
Titre abrégé :TIPTEP
Investigateur coordonnateur : Dr Nicolas REGENET
Promoteur : CHU de Nantes

2
Plan
Contexte
Description générale de l’étude
Déroulement de l’étude
Divers (autorisation CPP & Afssaps,
e-CRF, monitoring, BPC,
contacts à la CPRC)

3
Contexte (1)
Les TIPMP :
- Tumeurs caractérisées par une prolifération de l’épithélium
canalaire qui sécrète des quantités + ou – abondantes de
mucus causant une dilatation des canaux pancréatiques
-Affection initialement bénigne à potentiel malin :
Hyperplasie épithéliale papillaire
Dysplasie de bas grade
Dysplasie de haut grade
Carcinome in situ
Carcinome invasif

4
Contexte (2)
Indication opératoire (seul traitement curatif des
TIPMP dégénérées) :
si patient symptomatique (douleurs abdominales, pancréatite
aiguë, ictère rétentionnel, stéatorrhée, diabète, wirsungorragie)
OU
si risque élevé de malignité révélé par imagerie conventionnelle:
- Scanner abdominal
- Pancréato-IRM
- Echoendoscopie

5
Contexte (3)
Problème actuel : Imagerie conventionnelle faiblement
sensible (58 %) et faiblement spécifique (82%)
Ainsi, actuellement ,
- Certains patients asymptomatiques sont opérés alors que leur
TIPMP est bénigne et qu’ils pourraient justifier d’une
résection moins étendue (lourde morbidité des résections
étendues) ou d’une simple surveillance
-On laisse peut-être évoluer des TIPMP en stade pré-néoplasique
de dégénérescence alors que ces patients justifieraient d’une
résection précoce
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
1
/
45
100%