À la recherche de l`origine du VIH

1
UE8 – De l’agent infectieux à l’hôte
Dr Poubeau
Date : 13/04/2016 Plage horaire : 10h45- 12h45
Promo : DFGSM2 2015-2016 Enseignant : Dr POUBEAU
Ronéistes : Chitson Karen
Chitson Laura
Le VIH
I. Historique
1.
Apparition d’une nouvelle pandémie
2.
Origine de la pandémie de VIH : entre 1905 et 1940
3.
Origine de l’épidémie de VIH
4.
Une nouvelle maladie ?
5.
Découverte de la maladie
6.
Présentation du VIH
II. Epidémiologie
1.
A la Réunion
2.
En France
3.
En Afrique
4.
Dans le monde
III. Virologie
1.
Classification des virus responsables du SIDA
2.
Un rétrovirus
3.
Un lentivirus
IV. Transmission
1.
Les modes de transmission
2.
Variation des risques de contamination
3.
Contamination dans les accidents du travail
4.
Transmission par produits dérivés du sang
5.
Transmission materno-fœtale
V. Dépistage
1.
Le test ELISA
2.
Western Blot

2
3.
Test rapide d’orientation diagnostic (TROD)
VI. Physiopathologie de l’infection VIH
1.
Pénétration du virus dans la cellule cible
2.
Les caractéristiques de l’infection
3.
Les cellules cibles du VIH
4.
Mécanisme du déficit immunitaire lié au VIH
5.
Les réservoirs de VIH
6.
Taux de CD4
VII. L’infection à VIH
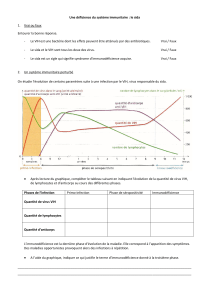
1.
Quatre phases dans l’infection à VIH
2.
La charge virale
3.
Histoire naturelle de l'infection par le VIH
4.
Classification clinique
5.
Pathologies infectieuses fréquemment associées au VIH
A. Tuberculose
B. Mycobaterium avium
C. Cytomégalovirus
D. Cryptococcose
E. Candidoses
F. Diarrhée à protozaires
G. Le sarcome de Kaposi
H. Infections à Herpesviridae
I. IST
J. HPV
K. Co infection VIH
VIII. Traitement
IX. Complications
associées
au
VIH et aux
traitements
antirétroviraux
1.
Lipodystrophie
2.
Vieillissement prématuré
Je m’occupe du VIH depuis 1984. J’ai vu cette maladie arriver, au début c’était une nouvelle maladie maintenant
c’est un peu différent, on peut voir l’évolution des traitements. On va essayer de balayer un peu le VIH que vous
reverrez plus tard dans vos cours.

3
I. Historique
1.
Présentation du VIH
- V: Virus
- I : Immunodéficience
- H : Humaine
En anglais : HIV = Human Immunodeficiency Virus
Ce sont des rétrovirus : ce sont des virus à ARN qui vont intégrer le matériel génétique dans la cellule sous
forme d’ADN. La transformation de l’ARN en ADN est possible grâce à la Reverse Transcriptase qui est
une enzyme majeure du VIH.
Famille des rétrovirus : virus à ARN caractérisés par leur enzyme appelée transcriptase inverse.
3 sous familles :
- les oncovirus, associés à des tumeurs et leucémies (exemple : HTVL)
- les spumavirus, à priori non pathognes
- les lentivirus, responsables de maladies à évolution lente (exemple : VIH)
Le virus fait parti de ces familles qui sont des maladies chroniques à évolution lente.
Le VIH appartient donc au groupe des rétrovirus et des lentivirus, famille des lentivirus, qui comprend le
VIH. Il n’y en a pas qu’un, il y a d’abord le HIV1 et on en a ensuite découvert un deuxième, le HIV2. Ils
dérivent du SIV (Simian Immunodeficiency Virus qui touche notamment les singes).
Découvert en 1983 par les équipes du Pr Luc Montagnier à l’institut Pasteur. Il a été découvert par une
équipe française en même temps que les équipes américaines. Il y a eu une polémique sur le sujet mais les
français l’on découvert un peu avant. La responsable de l’équipe française a gagné le prix Nobel de
médecine il y a quelques années.
Le VIH est responsable du SIDA = Syndrome d’Immuno Déficience Acquise (AIDS).
Mais attention : VIH (virus) diffrent de SIDA (Syndrome d’Immunodéficience acquise), syndrome acquis
après des années d’infection virale. Les patients qui ont le SIDA sont immunodéprimés, ont eu des maladies
opportunistes ou éventuellement des cancers.
Cependant aujourd'hui on peut être au stade SIDA et très bien se porter grâce aux traitements comme ne
pas aller bien alors qu'on n’a pas encore atteint ce stade.
2.
Découverte de la maladie
- 1979-1980 : On a remarqué dans une population avec une immunité normale une épidémie de
pneumocystoses (c’est un champignon extrêmement sévère), de leucémies et de sarcomes de Kaposi
(tumeurs cutanées noirâtres) sur la côte Ouest des Etats-Unis notamment à San Francisco, dans la
communauté homosexuelle. On parlait au départ de cancer gay au départ puis on l’a appelé le SIDA. On ne
comprenait pas pourquoi les patients non immunodéprimés faisaient des maladies extrêmement rares, puis
on a compris que leur taux de lymphocytes était très bas. Le SIDA est donc découvert avant le HIV.
- 1ère publication en juin 1981 de cette maladie dans le bulletin hebdomadaire (Morbidity and Mortality
Weekly Report) des Centres américains de surveillance des Maladies (Centers for Disease Control) :

4

5
Un groupe multidisciplinaire a mis en évidence, en culture dans le ganglion d’un patient qui était infecté, ce
virus lymphotrope (attaque les lymphocytes). On s’est rapidement rendu compte que l’on était face à un
virus qui se transmet par voie sanguine (montré par les hémophiles), par voie sexuelle (car concerne homo et
hétéro sexuels) et de la mère à l'enfant en 1982.
Ce n’est qu’en juillet 1985 que l’on a réussi à faire des sérologies car on ne parvenait pas à diagnostiquer la
maladie. A partir de cette date, les sérologies sont devenues obligatoires pour les transfusions et les dons
du sang car avant on ne pouvait pas savoir si le sang était contaminé (scandale du sang contaminé en 1985,
on aurait dû mettre en place cette sérologie 6 mois avant).
Le premier traitement, la zidovudine (ZDV) était un peu efficace mais ne marchait pas beaucoup car c’est un
seul médicament. Il y avait un nombre important d’infections opportunistes. La mortalité restait élevée. On
n’a pas fait beaucoup de progrès au niveau des traitements jusqu’en 1995 (trithérapies). De 1985 à 1995, il
y a beaucoup de morts par le SIDA. La grande période est de 1995 à 1996 où on a commencé à utiliser les
inhibiteurs de protéases, ce qui a fait diminuer la mortalité de manière importante ; on a trouvé un
traitement très efficace et le pronostic est devenu totalement différent.
3.
Une nouvelle maladie ?
Ce n’est pas une maladie nouvelle, elle a commencé au début du sicle dernier :
- 1915-1941 : Passages multiples de SIV (virus du singe) vers l’Homme, donnant naissance à la
pandémie d’infection par le VIH
- 1959 : 1er plasma VIH+ au Zaïre : 1er cas d’infection par le VIH-1 démontrée, mise en évidence sur
un échantillon de don de sang à Léopoldville (analyses réalisées en 1998)
Cas anecdotique :
- 1952 (USA) : Homme de 28 ans : infection à CMV + Pneumocystose
- 1957 (Mexique) : Homme de 43 ans : Sarcome de Kaposi viscéral
- 1958-59 (USA) : 3 Hommes 24-32 ans : Sarcome de Kaposi viscéral
- 1959 (GB) : Homme de 25 ans : infection à CMV + pneumocystose
- 1952 (USA) : H. 28 ans : CMV + PCP
- 1957 (Mexique) : H. 43 ans : SK viscéral
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
1
/
52
100%