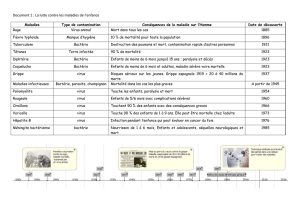
P2-UE8-Miltgen-Six_bactéries

1
UE8 : De l’agent infectieux à l’hôte
Date : 22/02/16 Plage Horaire : 14h-16h
Promo : P2 2015/2016 Enseignant : Dr Miltgen
Ronéistes : AHMADALLI Farah
DER KASBARIAN Léa
Six Bactéries et vingt-neuf pages
I. Bordetella Page 2
1. Généralités
2. Pouvoir pathogène
A. Forme classique de l’enfant
B. Forme du nourrisson (< 6 mois)
C. Forme de l’adulte
D. Physiopathologie
3. Diagnostic
A. Diagnostic direct
B. Diagnostic indirect
4. Traitement
5. Prévention – Vaccination
II. Campylobacter Page 4
1. Généralités
2. Epidémiologie
3. Pathologie :
4. Diagnostic au laboratoire :
A. Diagnostic direct
B. Diagnostic indirect
5. Traitement
III. Helicobacter pylori Page 8
1. Généralités
A. Habitat – Pouvoir pathogène
B. Epidémiologie
2. Clinique / Pathologie
3. Diagnostic
A. Diagnostic direct
B. Diagnostic indirect
4. Traitement
IV. Haemophilius sp Page 14
1. Généralités
2. Habitat, épidémiologie
3. Pouvoir pathogène
A. Chez l’enfant
B. Chez l’adulte
4. Physiopathologie
5. Diagnostic
6. Traitement
7. Prophylaxie
V. Legionella Pneumophila Page 17
1. Généralités
A. Caractéristiques
B. L’histoire d’une découverte
2. Habitat et pouvoir pathogène
A. Mode de transmission de
l’infection
B. Clinique
3. Le diagnostic
A. Diagnostic direct
B. Diagnostic indirect : sérologie
4. Traitement
5. Prévention
VI. Neisseria Page 22
1. Caractéristiques générales de Neisseria
2. Neisseria Gonorrhoae
A. Caractéristiques de l'agent
bactérien
B. Clinique
C. Diagnostic
D. Traitement
E. Conclusion
3. Neisseria Meningitis
A. Epidémiologie, habitat,
sérogroupes
B. Pouvoir pathogène
C. Diagnostic
D. Traitement
E. Conclusion
Pour les QCMs, le prof ne cherche pas à nous
piéger, il faut retenir les gros messages importants
(ce qui est urgent, les principaux moyens
diagnostic, le cheminement au labo...). Il ne s'arrête
pas trop aux exceptions et cas particuliers.
Cependant, il a dit qu'il s'inspirerait des questions
de Belmonte mais ne veut pas faire les mêmes, il
faut changer car sinon «vous avez toutes les
annales, c'est pas marrant hahaha». Ha.

2
I. Bordetella Le prof est passé rapidement sur ce germe : inutile de s’attarder sur les détails : retenir l’essentiel
1. Généralités
Coccobacilliaire, Gram négatifs
Immobile
Coloration bipolaire
Parmi les Bordetella : B pertussis et B parapertussis sont responsables de la coqueluche (durée et
intensité des symptômes moins marqués avec B parapertussis)
B pertussis est strictement humain
La bactérie tient son nom des quintes de toux (chant du coq) : toux rauques sèches évoluant pendant
plusieurs semaines avec des quintes caractérisées par des reprises respiratoires difficiles (apnées, cyanose...
vomissements (émétisantes))
B parapertussis est aussi retrouvé chez les ovins. B bronchiseptica peut être présent chez de nombreuses
espèces animales
2. Pouvoir pathogène
La coqueluche est une pathologie très contagieuse et présente des formes variables selon les sujets :
A. Forme classique de l’enfant
Dans la forme classique il y a 4 phases (il a détaillé ces phases) :
- une incubation qui va durer 2 à 3 semaines
- la phase catarrhale (quelques jours) : avec possibilité de purpura conjonctival
- la phase d’état avec une toux quinteuse (30-40j)
- une convalescence de plusieurs mois.
B. Forme du nourrisson (< 6 mois)
Peut provoquer une détresse respiratoire avec défaillance poly viscérale. Grave, potentiellement mortelle.
C. Forme de l’adulte
Toux persistante > 1 semaine : toux sèche, rauque avec quintes.
La vaccination a permis une diminution considérable des infections et complications (mortalité et
morbidité a diminué de 95%) en France. La protection vaccinale est de 10 ans environ s’il n’y a pas de
rappels. Il y a un recul du taux de vaccination et une diminution des rappels ce qui entraine une
réémergence de cette pathologie chez l’adolescent et l’adulte d’où la possible transmission vers les
nourrissons (gravissime chez le bébé) La vaccination reste donc recommandée, avec des rappels pendant
la petite enfance puis pendant l’adolescence. Il est également proposé une vaccination des jeunes parents,
des professionnels de santé en charge d’enfants (qui sont surveillés par la médecine du travail).
D. Physiopathologie
La bactérie se fixe sur les cellules trachéales (adhésines)
Après quelques temps
-Production de toxines ayant une action locale sur le fonctionnement des cellules ciliées
- = l'accumulation de mucus (paralysie du système d'épuration ciliaire)
- + réaction inflammatoire
Autres bordetelloses : formes respiratoires, bactériémiques voire localisées (surinfections de blessures...)

3
3. Diagnostic
A. Diagnostic direct
C’est une bactérie qui a des particularités de culture. On va donc privilégier la biologie moléculaire.
Prélèvements :
-Chez l’enfant : aspiration naso-pharyngée la plus précoce possible
-Chez l’adulte : utilisation d'un écouvillon du pharynx et PCR
Transport
-B pertussis : bactérie fragile = transfert rapide
La culture est de moins en moins utilisée
- Peut être réalisée dans les 3ères semaines de la maladie (Sp 100% ms Se 50%)
- En aérobiose, sur milieux spéciaux : nécessité de préciser cette suspicion au laboratoire car recherche
spécifique non réalisée en routine : milieu de Bordet-Gengou ou Regan-lowe (à base de pomme de terre)
- Culture à 35°C
- Culture lente : colonies hémolytiques n'apparaissant qu'après J3 (J7)
- Confirmation par agglutination avec anti-sérum spécifique
Envoi des souches au CNR.
B bronchiseptica cultive beaucoup plus aisément
Autre technique = biologie moléculaire ++++ : PCR : recherche d'ADN bactérien (Se > 80%). Elle est
utilisable après 3-4 semaines de signes cliniques. Niveau performances, c’est une technique rapide, avec
une bonne sensibilité et spécificité ! La conservation des échantillons se fait à 4°C. Remboursé depuis jan
2011
En gros ce qui sera davantage privilégier c’est la biologie moléculaire avec la nécessité de faire un
prélèvement relativement tôt (écouvillon, aspiration naso-pharyngée…)
B. Diagnostic indirect
Il est souvent peu contributif : on ne l’utilise plus. Il permet un diagnostic (rétrospectif ou tardif) si la
consultation et le prélèvement se font après la période où la bactérie peut être recherchée directement
(ELISA, immunoempreinte IgG anti-toxine). Il existe des difficultés d’interprétation. Les vaccinations
créent en effet des interférences. De plus le diagnostic indirect n’est plus remboursé (car faible spécificité).
4. Traitement
Macrolides (érythromycine (50 mg/kg/j en 3-4 prises pdt 14j) ou éventuellement les béta-lactamines,
cotrimoxazole. C’est un traitement qui va permettre d’avoir un effet sur la diminution de la contagiosité
mais l’effet sur les symptômes n’est pas toujours important à cause de la toxine.

4
5. Prévention – Vaccination
La mise en place de la vaccination dans les années 60 a permis une nette diminution de l’incidence.
On a modifié le calendrier vaccinal. Le vaccin est atténué (3 injections : 2, 3, 4 mois + rappel à 6 ans. Le
rappel est fortement conseillé aux professionnels au contact d'enfants et potentiels parents.
II. Campylobacter
1. Généralités
C’est la principale cause de gastroentérites bactériennes. Ce sont des bacilles gram négatif incurvés
(spiralés), de la famille des Epsilonprobacteria. Le genre Campylobacter contient 17 espèces. Les principales
espèces : C jejuni (entérites), C coli (entérites), C fetus (septicémies donc souvent retrouvés dans les
hémocultures ). Ce sont des zoonoses => réservoir animal important
Schéma : aspect incurvé au très fort
grossissement au microscope électronique. C’est
presque le seul germe qui a cet aspect en
bactériologie humaine.
2. Epidémiologie
Ce sont des bactéries commensales du tube digestif de nombreux oiseaux et mammifères notamment du
poulet, qui un réservoir naturel de Campylobacter jejuni. 40 à 80 % des carcasses de poulets sont
contaminées à la distribution.
Elle a une survie prolongée dans l’environnement (plusieurs semaines à 4°C) notamment dans l’eau et le lait
mais elle ne peut pas se multiplier dans l’aliment (contrairement eux salmonelles par ex)
On a une transmission selon 2 modes par l'alimentation :
1 : sporadique, majoritaire (consommation de la viande de poulet crue ou insuffisamment cuite, car la
cuisson détruit ces bactéries).
2 : épidémique, spectaculaire mais rare (lait crus, eaux potables contaminées)
De manière générale, les cas sporadiques sont dus aux aliments et les cas épidémiques aux boissons.

5
Cycle de contamination (voie la plus
fréquente par ingestion de volaille)
Les Facteurs de riques sont nombreux mais
ce qu’il faut retenir c’est vraiment la
consommation de viande de bœuf ou de
poulet crue.
3. Pathologie :
Manifestations cliniques digestives, avec des troubles gastro intestinaux, des vomissements et des diarrhées.
Il y a peu de variations de manifestations cliniques entre les différentes espèces de campylobacter. Il y a peu
de différences par rapport aux autres infections du tube digestif. (par exemple entre shigella et
campylobacter : il n’y aura pas une symptomatologie plus bruyante que l’autre).
Elle survient surtout chez l’enfant de moins de 5 ans sous forme de diarrhées aigües.
L’incubation est de 1 à 10 jours après ingestion de la bactérie.
La phase initiale : 2jours avec fièvre élevée frissons (aspécifique)
La phase digestive : nausées, vomissements, douleurs, abdos, diarrhées aqueuses puis muqueuses,
sanglantes, purulentes (entéroinvasif + toxines)... (toujours aspécifique)
La durée de l’expression clinique est de 8-10jours mais il y’a expulsion fécale de Campylobacter pendant
plusieurs semaines post infection (contamination possible par manque d’hygiène)
Ainsi on a 2 types d’épidémies : nosocomiales et communautaires
On observe 25% de rechutes (symptômes moins marqués)
La distribution saisonnière est moins marquée que pour Salmonella mais il y’a un pic en saison chaude
L’espèce la plus fréquente est donc Campylobacter jejuni (75%).
Le nombre de cas annuel estimé en France est non négligeable avec 18 000 cas/ans pour C.jejuni dont 3000
hospitalisations), avec des cas de septicémie qui sont rares (moins de 1% des infections qui surviennent
plutôt pour des terrains fragilisés comme les immunodéprimes ou les âges extrêmes de la vie) pour C jejuni
mais plus fréquents avec C fetus.
Si on considère toutes les infections à Campylobacter pour les enfants, il y a 50% des hospitalisations
pédiatriques. Donc à bien rechercher chez les enfants
C’est la première cause de gastroentérite bactérienne.
Des complication secondaires peuvent apparaître. Elle sont de type arthritiques (1% des complications)
On peut avoir des complications graves : syndrôme de Guillain-Baré (polyradiculonévrite ascendante
régressive postinfectieuse) :
trouble de déglutition voire paralysie des muscles respiratoires (ventilation artificielle)
mimétisme moléculaire entre le LPS de certains sérogroupes de C jejuni et la constitution des gaines de
myéline
Symptômes débutent en général 1 à 3 semaines après l'infection
Meuh.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
1
/
29
100%