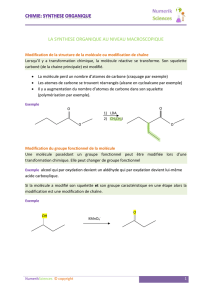
Physique des atomes et des molécules: ordres de grandeur

r=a0
a0=4π²0¯h2
m∗e2
m∗e
a0= 0,53
Z
1/Z
a
∆p.∆x∼¯h a ∼
∆x a ∼¯h/∆p∆p∼√2mE E
E∼e2
4π²0a
a∼¯h
q2me2
4π²0a

a∼4π²0¯h2
2me2
a0
En=−EI
n2
EI= 13,6
EI=1
2
e2
4π²0a0
En−En0∼
E=hν E = 1 ν= 2,4.1014
λ= 1,24µ
λ∼µ
+Ze
En=−13,6
n2eV ×Z2

hν =λ= 0,124
Z∼30

V(r)
V(r) = 1
2k(r−re)2
re
re∼
Ev= (v+1
2)hνvib
νvib =1
2πsk
µ

µ=m1.m2/(m1+m2)
v→ ∞
h
hνvib ∼0,1eV
νvib = 2,4.1013Hz
λvib = 12µm
k
V(r)
Der→ ∞ De∼
∆v > 1
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
1
/
12
100%