205kb - Collège Notre

Collège Notre-Dame
de Jamhour
Classe de Terminale SV
Date : Mardi 28 avril 2015
1/6
Corrigé de l'Examen de Chimie
Présenter le travail avec un souci d’ordre et de soin. (1 pt)
L’utilisation de la calculatrice non programmable est autorisée.
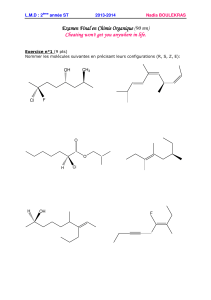
Exercice I : La synthèse du méthacrylate de méthyle (14 pts)
1. La molécule de méthacrylate de méthyle ou MAM
La formule topologique du MAM est représentée ci-contre :
1.1. Écrire la formule semi-développée de cette molécule en entourant son groupe
caractéristique et nommer la famille chimique associée. (1 pt)
Formule semi-développée du MAM :
Groupe caractéristique : ester
Famille chimique : ester
2. Synthèse du MAM par le procédé MGC (Mitsubishi Gas Chemicals)
2.1. Associer aux réactions A, C et D du processus une catégorie de réaction parmi les suivantes :
élimination, addition ou substitution. Justifier. (3 pts)
La réaction A constitue une réaction d’addition :
Les atomes du cyanure d’hydrogène HCN s’additionnent sur la molécule de propanone. (Ou 2
réactifs donnent un seul produit et la liaison double se transforme en liaison simple).
La réaction C est une réaction de substitution : le groupe méthyle CH3 de l’ester se substitue au
groupe amino NH2.
La réaction D présente une élimination : deux groupes d’atomes (OH et H) sont éliminés du réactif
et la liaison simple se transforme en liaison double.
2.2. Le mécanisme réactionnel de la réaction A du procédé MGC débute par l’étape suivante :
H+ + - C ≡ N + → + H+
O
O
CH3 C
CH3
O
CH
3
C
CH
3
O
–
CN
H3C
O
C
O
C
CH3
CH2

2/6
Recopier cette équation, ajouter les doublets libres manquants sur les différentes entités en
présence (molécules et ions) et représenter les flèches courbes rendant compte de cette première
étape du mécanisme.
Justifier précisément l’orientation de ces flèches. (3 pts)
H++ + H+
Les atomes C, N, O respectent la règle de l’octet, ils sont entourés de quatre doublets.
Les flèches sont orientées du site donneur de doublet vers le site accepteur.
L’atome C porteur d’une charge négative est un site donneur de doublets.
Le carbone central de la propanone porte une charge partielle positive car l’électronégativité de
l’atome d’oxygène voisin est supérieure à la sienne. Il constitue un site accepteur de doublets.
Une autre flèche courbe montre le mouvement de l’un des doublets d’électrons qui constituent la
liaison double vers l’atome d’oxygène qui prend une charge négative.
2.3. Afin de vérifier que le procédé conduit aux produits attendus, on compte utiliser la
spectroscopie IR appliquée pour chacune des espèces suivantes : propanone, méthanoate de
méthyle et MAM. La spectroscopie IR permet-elle de différencier ces trois espèces ? Justifier.
(3 pts)
La propanone sera repérable par la présence dans son spectre IR d’un pic caractéristique entre 1650
et 1730 cm-1 (C=Océtone).
Les spectres du méthanoate de méthyle et du MAM présenteront un pic entre 1700 et 1740 cm-1
(C=Oester) et un pic entre 1050 et 1450 cm-1 (Ctet – O).
Seul le spectre du MAM présentera un pic entre 1625 et 1685 cm-1 (C=C).
Il est donc possible de différencier ces trois espèces grâce à la spectroscopie IR.
Remarque : Il faut tout de même noter que les pics des C=Oester et C=Océtone risquent d’être
difficiles à distinguer. Et que le pic de la liaison Ctet – O risque d’être peu visible dans l’empreinte
digitale (σ < 1500 cm -1) de la molécule.
3. Synthèse du MAM et respect de l’environnement
3.1. Les économies d’atomes sont égales à 0,465 pour le procédé ACH et
0,690 pour le procédé MGC.
Déterminer la valeur de l’économie d’atomes pour le procédé isobutène. Commenter le résultat
obtenu et conclure en justifiant si l’un des trois procédés peut être privilégié du point de vue du
respect des principes de la chimie verte. (4 pts)
L’économie d’atomes est définie par Ai i
a M(produit recherché)
Eb M(réactif)
.
Dans le cas du procédé isobutène,
on a
2
MAM
A
isobutène O méthanol
1 M
E3
1 M M 1 M
2
CH
3
C
CH
3
O
-|C N|
CH
3
C
CH
3
O
C
N
–

3/6
A1 100,0
E3
1 56,0 32,0 1 32,0
2
= 0,735
Cette valeur est la plus proche de 1 parmi les trois procédés. Le procédé isobutène est le plus
efficace en économie d’atomes et génère moins de déchets.
3.2. Au regard de la prévention et de l’économie d’atomes :
Le procédé isobutène est à privilégier car il a la meilleure économie d’atomes donc produit le moins
de déchets.
On peut ajouter que le procédé MGC produit du méthanamide qui est valorisé en HCN, tandis que le
procédé ACH produit du NH4HSO4 qui est difficile à valoriser.
Concernant l’environnement et la nocivité des substances :
- Les procédés ACH et MGC utilisent du cyanure d’hydrogène indiqué comme étant
toxique dans le doc. 4 ;
- Le procédé ACH utilise de l’acide sulfurique H2SO4 (corrosif) ;
- Les procédés isobutène et ACH nécessitent du méthanol (nous n’avons pas d’information
à propos de sa toxicité) ;
- Le procédé isobutène consomme du dioxygène (gaz qui facilite les combustions), et
produit de l’eau.
Au regard de ces informations, le procédé ACH semble le plus polluant, tandis que le procédé
isobutène semble le moins polluant.
Pour respecter les principes de la chimie verte, étudions enfin les besoins énergétiques :
- Le procédé MGC comporte des étapes nécessitant une température de à 500°C ;
- Pas d’informations sur le procédé ACH ;
- Le procédé isobutène fait mention de températures comprises entre 280°C et 306°C.
Pour conclure malgré le manque de quelques informations, le procédé isobutène semble à privilégier
du point de vue du respect des principes de la chimie verte.
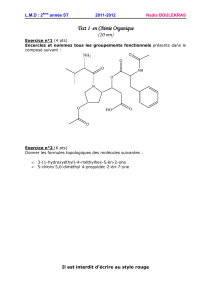
Exercice II : A la recherche des molécules de la vie (15 pts)
1. La formule générale des acides aminés est donnée ci-dessous :
Justifier le nom d'acide aminé attribué à cette molécule. (1 pt)
Un acide aminé est un composé bi-fonctionnel qui contient les groupes caractéristiques amine et
carboxyle.
Le groupe carboxyle donne le nom « acide ».
R est un radical variable qui diffère d’un acide aminé à
l’autre ; il peut être soit un atome H, soit un groupe
alkyl, soit une chaîne comportant des groupes
caractéristiques divers.
NH
2
COOH
CH
R
NH
2
COOH
C
H
R
Groupe
amino
Groupe carboxyle

4/6
Le groupe amino donne l’adjectif « aminé ».
Parmi les acides amines identifiés dans la météorite de Murchison se trouvent la leucine (abréviation
Leu) et l`isoleucine (abréviation Ile) dont les formules semi-développées sont données ci-dessous :
Leucine lsoleucine
2.1. On veut différencier la leucine de l’isoleucine par une technique d’identification appropriée.
Trois techniques simples d’identification de molécules peuvent être envisagées en chimie
organique :
- la spectroscopie de masse qui sépare les entités chimiques en fonction de leur masse et qui
identifie ces masses,
- la spectroscopie infrarouge,
- la spectroscopie de résonance magnétique nucléaire.
Laquelle (ou lesquelles) de ces trois techniques peut (peuvent) être choisie(s) pour différencier les
molécules de leucine et d’isoleucine ? On expliquera pourquoi l’(ou les) autre(s) technique(s) n'est
(ne sont pas) adaptée(s) à cette différenciation. (3 pts)
La spectroscopie de masse n’est pas adaptée : les deux molécules ont même masse molaire.
La spectroscopie IR n’est pas adaptée : les deux molécules possèdent les mêmes groupes
caractéristiques et donc les mêmes fonctions chimiques
La spectroscopie de RMN est une bonne méthode. Elle fournit un spectre différent selon la structure
de la molécule, en effet les atomes d’hydrogène apparaissent différemment selon leur environnement
dans la molécule.
2.2. Les spectres de RMN des deux molécules sont réalisés en ajoutant un peu d’"eau lourde" à
l’échantillon. On appelle "eau lourde" l’eau deutérée D2O. L'objectif de cet ajout est de permettre
le remplacement des protons acides par des atomes de deutérium, c'est-à-dire les protons des
groupes COOH et NH2. Le deutérium ne provoquant aucun signal en RMN du proton,
la conséquence de cet ajout est de faire disparaître les signaux dus aux protons des groupes
COOH et NH2.
Ce spectre est-il celui de la leucine ou de l`isoleucine ? Justifier la réponse. (4 pts)
Le spectre de RMN de l’isoleucine comporterait 5 signaux et non pas 4.
Un doublet intégrant pour 6 H, δ = 0,9 ppm : 6 atomes d’H équivalents avec un seul H voisin.
Un multiplet intégrant pour 1 H, δ = 1,5 ppm : 1 atome d’H ayant de nombreux H voisins.
Un triplet intégrant pour 2 H, δ = 1,6 ppm : 2 atomes d’H équivalents ayant deux H voisins
Un triplet intégrant pour 1 H, δ = 3,4 ppm : 1 atome d’H (différent des précédents) ayant deux H
voisins. (Le déblindage est plus important à cause de la proximité des atomes électronégatifs O et
de N).
C’est le spectre de la leucine :
CH
3
NH
2
OH
O
C
CH
CH
2
CH
H
3
C
CH
3
NH
2
OH
O
C
CH
CH
CH
2
H
3
C
CH
3
ND
2
COOD
CH
CH
2
CH
H
3
C
6H à 0,9 ppm
1H à 1,5 ppm 2H à 1,6 ppm 1H à 3,4 ppm

5/6
3. Les scientifiques font allusion à la chiralité des molécules produites et utilisées par tous les êtres
vivants de la Terre, alors que les réactions de synthèses chimiques produisent en général des
mélanges dits « racémiques ››.
3.1. Que signifient les termes « racémique ›› et « chirale ›› ? (1,5 pts)
Une molécule chirale est une molécule non superposable à son image dans un miroir plan. Une
molécule qui possède un atome de carbone asymétrique est chirale.
Un mélange racémique contient deux énantiomères (molécules images l’une de l’autre dans un miroir
plan) en quantités égales.
3.2. Illustrer ces deux termes à l'aide de la leucine. (1,5 pts)
Dans le cas de la leucine, le carbone asymétrique est celui porteur des groupes carboxyle et amino.
Les deux énantiomères sont les suivants :
Molécule A Molécule B
Un mélange contenant autant de molécules A que de molécules B est un mélange racémique.
4. Les chimistes se sont efforcés de reconstituer en laboratoire les familles de longues chaînes
biologiques indispensables au fonctionnement de la cellule.
4.1. À partir d'un mélange initial de leucine et d’isoleucine, combien de dipeptides différents peut-
on a priori obtenir ? Justifier. (2 pts)
Lors de la formation d’un dipeptide, la fonction acide carboxylique d’une molécule d’acide aminé
(Leu ou Ile) réagit avec la fonction amine d’une autre molécule d’acide aminé (Leu ou Ile) . Il y a
donc 22 = 4 possibilités :
Leu-Leu Leu-Ile Ile-Leu Ile-Ile
4.2. Un dipeptide obtenu est nommé à partir de l’abréviation des deux acides aminés ayant permis de
l’obtenir.
Écrire l’équation de la synthèse du dipeptide Leu-Ile en encadrant les groupes qui doivent être
protégés pour obtenir ce seul dipeptide. (2 pts)
Pour faire réagir la fonction acide carboxylique de la leucine avec la fonction amine de l’isoleucine, il
faut empêcher les réactions parasites en bloquant la fonction amine de la leucine et la fonction acide
carboxylique de l’isoleucine :
Leu-Ile
NH2
COOH
H
C
CH
2
(CH
3
)
2
HC
CH(CH
3
)
2
CH
2
H
H2N
HOOC
C
NH
2
COOH
CH
CH
2
(CH
3
)
2
CH
CH
3
NH
2
COOH
CH
CH
H
5
C
2
+
H2O
Leu
Ile
+
CH
3
O
C2H5
CH
CH(CH3)2
CH
2
O
OH
C
CH
NH
C
CH
NH
2
1
/
5
100%