Le conditionnement de peur à l`odeur chez le rat

1
Mémoire d'odeur, Mémoire de peur…
Ou comment étudier la mémoire émotionnelle olfactive chez le Rat
Yannick Sevelinges1, Regina Sullivan2, Rémi Gervais1 et Anne-Marie Mouly1
1 Neurosciences Sensorielles, Comportement, Cognition, CNRS-Université de Lyon, France
2 Department of Zoology, University of Oklahoma, USA
Emotion et Mémoire
Les émotions jouent un rôle essentiel dans notre mémoire autobiographique : lorsque nous
mémorisons une information sensorielle dans un contexte émotionnel fort, qu'il soit agréable ou
désagréable, le souvenir formé acquiert un statut particulier, qui le rend résitant à l'oubli (Cahill et
McGaugh, 1998). Les odeurs, plus que tout autre stimulus sensoriel, sont intimement liées aux
émotions, ainsi que l'a exprimé Marcel Proust dans son célèbre texte de "La madeleine". Plusieurs
travaux réalisés chez l'homme ont montré que les odeurs ont cette capacité particulière de faire
resurgir des souvenirs de façon quasi automatique (pour revue, voir Chu et Downes, 2000) et que
les souvenirs évoqués par des odeurs ont une forte valence émotionnelle (Herz, 1996).
Les émotions, et plus particulièrement leur rôle dans les grandes fonctions cognitives comme la
mémoire, sont aujourd'hui l'objet d'un intérêt grandissant en neurosciences, grâce notamment aux
travaux d'Antonio Damasio chez l'homme (Damasio, 2003) et de Joseph LeDoux chez l'animal
(LeDoux, 2000).
Une émotion particulière : la peur
Une grande partie de nos connaissances en neurobiologie sur les relations entre mémoire et émotion
a été obtenue chez l'animal à partir d'une émotion particulière : la peur. La peur est une réaction
normale déclenchée lorsque notre organisme perçoit ou anticipe un danger. Son rôle est de nous
protéger en plaçant notre corps en alerte et en favorisant de ce fait le déclenchement d'une réponse
rapide et adaptée, c'est-à-dire faire face au danger ou le fuir. Chez l'homme, la peur peut être définie
selon deux composantes : une composante implicite physiologique et une composante explicite
subjective. La première regroupe l'ensemble des réponses de défense de notre organisme face au
danger : comportement de fuite ou d'immobilité, décharge d'hormones de stress, tremblements,
sueurs, augmentation de la pression sanguine et du rythme cardiaque. Ces réponses sont
automatiques, innées, et pour la plupart communes à l'ensemble des espèces animales. La
composante explicite quant à elle, fait référence à l'expérience consciente du sentiment de peur et
des raisons qui la causent. Cette composante est objectivable chez l'homme principalement par le
biais du langage. L'existence d'une conscience chez l'animal, que ce soit la conscience de ses actes,
ou encore la conscience de soi, est une question largement débattue dans la littérature (Griffin et

2
Speck, 2004). Pour cette raison à laquelle s'ajoutent des difficultés d'ordre méthodologique liées à la
mise en œuvre de mesures comportementales adaptées, la composante explicite de peur n'est que
rarement étudiée chez l'animal. A l'inverse, la composante implicite a été et continue d'être l'objet
d'un très grand nombre d'études expérimentales chez l'animal, et ce au travers d'un apprentissage
aussi simple que célèbre : le conditionnement de peur.
L'objet de cette revue est de présenter dans une première partie, les grandes lignes du circuit
neuronal impliqué dans le conditionnement de peur au son qui constitue à l'heure actuelle le modèle
de référence, et de lui comparer le réseau mis en évidence dans le conditionnement de peur à une
odeur. Cela nous amènera à identifier certaines particularités du circuit de la peur conditionnée à
l'odeur qui viennent s'ajouter aux arguments en faveur de l'existence de liens privilégiés entre les
odeurs et les émotions. Dans une deuxième partie, nous nous intéresserons à l'ontogénèse de
l'apprentissage de peur conditionnée à l'odeur, ainsi qu'aux conséquences à long-terme d'un
apprentissage néonatal de ce type.
Le conditionnement de peur chez le Rat : Un modèle de choix pour l'étude de la neurobiologie
de la mémoire émotionnelle
On distingue classiquement deux grands types de peur chez l'animal : la peur innée, engendrée par
exemple par la vue ou l'odeur d'un prédateur (Takahashi, Nakashima, Hong et Watanabe, 2005), et
la peur apprise ou conditionnée qui constitue l'un des modèles de prédilection pour l'étude de la
neurobiologie de la mémoire émotionnelle et est appréhendée expérimentalement par le biais du
conditionnement de peur.
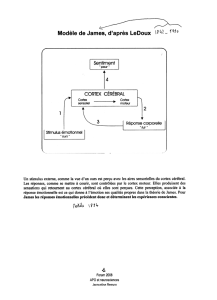
Le conditionnement de peur repose sur le principe suivant : un stimulus sensoriel neutre (appelé
stimulus conditionnel ou SC), -généralement un son-, est présenté à l'animal, -généralement un rat-,
pendant quelques secondes à la fin desquelles on applique un léger choc électrique nociceptif
(appelé stimulus inconditionnel ou SI) aux pattes de l'animal (Figure 1). Après quelques
associations de ce type, le son présenté seul, en l'absence du choc électrique, induit une réponse
émotionnelle caractéristique d'un état de peur : l'animal se fige (comportement de "freezing"), ses
poils se hérissent, son organisme libère des hormones de stress, sa pression artérielle et sa fréquence
cardiaque augmentent. Cet apprentissage de type pavlovien est acquis très facilement, retenu sur de
longues périodes et observé dans de très nombreuses espèces (de la mouche à l'homme en passant
par le rat), d'où l'engouement dont il a été l'objet dans le cadre d'une approche translationnelle de
l'étude de la mémoire émotionnelle.

3
Figure 1 : Protocole du conditionnement de peur au son. SC : Stimulus conditionnel, SI :
Stimulus inconditionnel. (Adapté de LeDoux, 2007)
Les circuits neuronaux du conditionnement de peur au son
Notons, qu’à ce jour, la majorité des études de peur conditionnée chez le rat ont été faites en
utilisant un son comme stimulus conditionnel (pour revue, voir LeDoux, 2000 ; Maren 2001;
Medina, Christopher Repa, Mauk et LeDoux, 2002). Les travaux du groupe de Joseph LeDoux ont
contribué de façon majeure à la connaissance des circuits impliqués dans le conditionnement de
peur au son. Ces études ont notamment révélé que cet apprentissage met en jeu une structure clé du
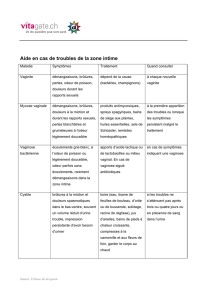
cerveau : l'amygdale (Figure 2).
Pour que l'association entre un SC sonore et un SI nociceptif puisse avoir lieu, il est indispensable
que d'un point de vue anatomique les voies transmettant ces deux types de stimuli convergent
quelque part dans le cerveau. Cette condition est remplie au niveau de l'amygdale, et plus
particulièrement du noyau latéral (LA) qui fait partie du complexe basolatéral de l’amygdale
(BLA). Les entrées auditives sur le LA proviennent à la fois du thalamus auditif (voie thalamique)
et du cortex auditif (voie corticale). Le LA reçoit aussi des afférences issues du stimulus nociceptif
qui transitent par le thalamus somatosensoriel ainsi que par le cortex somatosensoriel. Le LA est
donc en position de pouvoir former un lien entre SC et SI et ainsi créer une mémoire associative.

4
Figure 2 : Circuits cérébraux du conditionnement de peur au son
SC : Stimulus conditionne ; SI : Stimulus inconditionnel ; LA : Noyau latéral ; CE : Noyau
central ; SG : Substance grise périaqueducale ; HL : Hypothalamus latéral ; NPV : Noyau
paraventriculaire.(Adapté de Medina et LeDoux, 2002)
Un fois le lien établi, il reste à savoir comment est engendrée la réponse de peur apprise. Le LA
envoie des projections directes sur le noyau central de l'amygdale lequel contrôle l'expression des
réponses de peur via les connections qu'il entretient avec différentes structures du tronc cérébral.
Ainsi les efférences du noyau central vers l'hypothalamus latéral sont responsables des réponses de
variation de pression sanguine alors que les projections vers le noyau paraventriculaire de
l'hypothalamus contrôlent les réponses hormonales (libération de corticostérone) et celles vers la
substance grise périaqueducale induisent la réponse d'immobilité de peur plus connue sous le terme
de "freezing".
Les données anatomiques, pour indispensables qu'elles soient, ne permettent pas à elles seules
d'attribuer un rôle aux différentes structures concernées dans l'apprentissage de peur conditionnée
au son. Pour cela, différentes approches expérimentales ont été utilisées. Ainsi, des techniques de
lésion ou d'inactivation transitoire de l'amygdale ont permis de montrer que cette structure était
indispensable pour l'acquisition de l'apprentissage ainsi que pour sa rétention à long-terme (pour
revue voir Maren, 2005) suggérant l'idée qu'elle pourrait constituer le lieu de stockage permanent de
l'association SC-SI.

5
Si l’amygdale est le lieu de stockage permanent de l'apprentissage, on doit pouvoir mettre en
évidence une "trace" de cette association au niveau neuronal. L'un des mécanismes cellulaires les
plus en vogue à l'heure actuelle pour le stockage de la mémoire est le phénomène de potentialisation
à long terme (PLT) qui consiste en un renforcement durable de la transmission synaptique au sein
du réseau neuronal impliqué (pour revue voir Martin, Grimwood et Morris, 2000). Ce phénomène a
été décrit pour la première fois par Bliss et Lomo (1973) sur des tranches d'hippocampe de lapin
suite à l'application d'une stimulation électrique à haute fréquence des axones afférents de la voie
perforante. De nombreuses études électrophysiologiques ont permis d'aboutir à la conclusion que
les neurones de l'amygdale possédaient toute la machinerie cellulaire et synaptique pour mettre en
œuvre une plasticité synaptique durable comparable à la PLT hippocampique (Maren, 1999).
L'étape ultérieure a consisté à rechercher si ce type de plasticité était aussi observé en situation
naturelle (par opposition à son induction artificielle par une stimulation électrique tétanisante) suite
à un apprentissage. C'est ainsi que Rogan, Staubli et LeDoux (1997) ont montré que l'apprentissage
de peur conditionnée au son induisait une augmentation de la réponse évoquée par le SC sonore
dans l'amygdale latérale. Cette augmentation présente de nombreuses similitudes avec la facilitation
observée suite à l'induction d'une PLT dans la voie thalamique auditive. Ainsi, le son appris va
désormais induire dans les voies auditives et au niveau du LA une réponse potentialisée. La forte
activation neuronale qui en résulte va ensuite se propager au noyau central de l'amygdale et induire
la réponse de peur. En somme, suite à la formation du lien SC-SI au niveau du LA, le son seul
devient capable d’activer les structures cibles du LA, responsables de l’état de peur.
Si l'ensemble de ces données met en avant le rôle clé de l'amygdale dans l'apprentissage de peur
conditionnée au son, il ne signifie pas pour autant que l'amygdale est la seule structure impliquée ni
qu'elle code tous les aspects de l'apprentissage aversif. Ainsi plusieurs expériences ont par exemple
montré que l'activité des neurones du thalamus auditif ainsi que ceux du cortex auditif primaire était
modifiée des suites de l'apprentissage (Quirk, Armony et LeDoux, 1997 ; Edeline, 1999; pour revue
voir Weinberger 2004). Concernant le rôle respectif de la voie directe thalamus-amygdale et de la
voie indirecte thalamus-cortex-amygdale, LeDoux (2000) propose que la première est rapide et
grossière, alors que la deuxième est lente et précise (Figure 2). Pour illustrer la fonction de ces deux
voies, LeDoux (1994) prend un exemple dans la modalité visuelle, celui du promeneur qui marche
dans les bois et qui, au détour d’un arbre, voit, à demi enfoui dans les feuilles, ce qui ressemble à un
serpent. La voie thalamique, qui se projette directement sur l’amygdale, fait une analyse grossière
de cet objet et permet au cerveau de détecter un danger potentiel et d'enclencher une réponse quasi-
immédiate de défense (sursaut puis immobilisation, sécrétion d’hormones de peur qui préparent
l’organisme à la fuite…). En parallèle, l'information visuelle accède plus tardivement au cortex où
elle est analysée finement. S’il s’avère qu’il s’agit véritablement d’un serpent, le cortex visuel
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
1
/
21
100%