Propriétés générales du noyau Propriétés générales du noyau

Propriétés générales du noyau
1
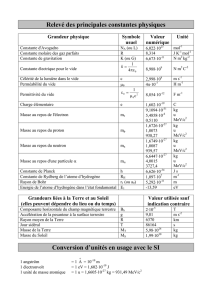
les différentes unités
unité de masse atomique : u.m.a définie à partir de la masse atomique de 12C
Matome(12C) = 12 uma = 12 mu↔1 mu= 10-3/NAvogadro = 1,66054 10-27kg = 931,494 MeV/c2
M
= 1 00728
uma
;
M
= 1 00867
uma
; M(
1
H) = 1 007825
uma
M
proton
= 1
,
00728
uma
;
M
neutron
= 1
,
00867
uma
; M(
H) = 1
,
007825
uma
avec c = 2,99792 108ms-1, NAvogadro = 6,022 1023 mole-1 et 1 eV = 1,6 10-19 J
excès de masse en uma : ΔMatome(A,Z)uma = Matome(A,Z)uma –A telqueΔ(12C) = 0
excès de masse en MeV/c2: ΔMatome(A,Z)MeV = Matome(A,Z)MeV – 931,494 A
Ex : Ruthénium et Technécium
Ru
100
44
cT
100
43
•Matome(100,44) = 99,904219 uma = 93 060,18 MeV/c2
•Matome(100,43) = 99,907657 uma = 93 063,38 MeV/c2
pM
atome
(
100
,
43
)
-M
atome
(
100
,
44
)
= 3
,
2 10-3 uma
(
ou 3
,
2 MeV
/
c2
)
: ~ 10-5 de M
atome
44
atome
(,)
atome
(,) ,
(
,
/
)
atome
Excès de masse
•
Δ
M
atome
(
100
,
44
)
= - 0
,
0
9
5
7
81 uma = -8
9,
21
9
46 MeV
/
c2
atome
(,)
,97
9, 9
/
•ΔMatome(100,43) = - 0,092343 uma = -86, 01698 MeV/c2
Bl’intérêt de l’excès de masse est de faire apparaître les chiffres significatifs pertinents
Propriétés générales du noyau
2
les différentes unités
masse d’un no
y
au
/
masse d’un atome
y/
Matome(A,Z) c2= Mnoyau(A,Z)c2+ Zmec2-E
l,e
avec El,e ~ qq eV – qq keV négligeable / Zmec2
BMatome(A,Z)c2~ Mnoyau(A,Z) c2+ Zmec2
BMnoyau(A,Z) c2~ Matome(A,Z) c2-Zm
ec2
Ex : Ruthénium et Technécium
•M
atome
(
100
,
44
)
= 99
,
904219 uma = 93 060
,
18 MeV
/
c2pM
noyau
(
100
,
44
)
= 93 037
,
696 MeV
/
c2
Ru
100
44 cT
100
43
atome
(,) ,
,
/
noyau
(,) ,
/
•Matome(100,43) = 99,907657 uma = 93 063,38 MeV/c2 pMnoyau(100,43) = 93 041,407 MeV/c2
Propriétés générales du noyau
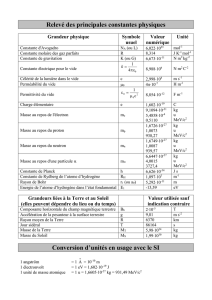
3
Unités et calculs d’ordre de grandeur
MeV
↔
kg
MeV
↔
kg
Nombre de protons, de neutrons et d’électrons dans un corps humain ?
M
corps
= 70 k
g
= 2 1028
p
rotons
,
2 1028
,
neutrons et 2 1028 électrons
corps
g
p,
,
masse des électrons dans le corps ? me- = 0,511 MeV/c2= 9,1 10-31kg
pMasse totale d’électrons = 18 g
R d’
C ?
2/
3
R
ayon
d’
un
atome
C ?
rgraphite =
2
g
/
cm
3
rayon d’un atome C ~ 1 Å
rayon du noyau de C = 1,2 A1/3 ~ 2,5 fm ~ 4 ordres de grandeur
Mandarine de 2,5 cm de rayon = noyau, quelle est le rayon R de l’atome ?
R ~ 1 km
densité nucléaire en kg/cm3
ρ0= 0,16 nucléon/fm3↔ρ
0= 2,68 1011 kg/cm3
La masse volumique de la matière solide : [ 0,5 – 20] g/cm3 14 ordres de grandeur
Propriétés générales du noyau
4
énergie de liaison du noyau/masse d’un atome
M
atome
(
A
,
Z
)
c2=
M
noyau
(
A
,
Z
)
c2+ Zm
e
c2=
[
Z
M
p
c2+
(
A-Z
)
M
n
c2
–
B
(
A
,
Z
)]
+ Zm
e
c2
M
atome
(,)
M
noyau
(,)
e
[
M
p
(
)
M
n
(,)]
e
En combinant les Z électrons avec les Z protons, on fait apparaître Z atomes 1H
BMatome(A,Z) c2~ Z M(1H) c2+ (A-Z)Mnc2–B(A,Z)
BB
(
A,Z
)
~ [Z M
(
1H
)
+
(
A-Z
)
M
n
–M
atome
]c2
()
(
)
(
)
n
atome
Matome(1H) = 938,7829 MeV/c2
Mn= 939,55 MeV/c2
énergie de liaison du noyau/excès de masse
B(A Z) [
Z
Δ
M(
1
H) + (A
Z)
Δ(
)
Δ
M
(A Z)]
2
B(A
,
Z)
~
[
Z
Δ
M(
1
H) + (A
-
Z)
Δ(
n
)
-
Δ
M
atome
(A
,
Z)]
c
2
Avec ΔM(1H) = 0,007825 uma = 7,2889 MeV/c2
Δ
(n)
= 0 008665
uma
= 8 0714
MeV
/c
2
Δ
(n)
= 0
,
008665
uma
= 8
,
0714
MeV
/c
2

Propriétés générales du noyau
5
énergie de liaison du noyau
expression
“
directe
”
expression
directe
B(A,Z) = [ZMp+ (A-Z)Mn–M
noyau(A,Z)]c2
à
p
artir de l’excès de masse de l’atome
p
B(A,Z) = [ZΔM(1H) + (A-Z)Δ(n) - ΔMatome(A,Z)]c2
B
(
A
,
Z
)
au
g
mente avec le nombre de nucléons A
(,) g
Ex : Ruthénium et Technécium
/
2
Ru
100
44 cT
100
43
•ΔMatome(100,44) = -89, 21946 MeV
/
c
2
pB(100,44) = 861,0676 MeV
•ΔMatome(100,43) = -86, 01698 MeV/c2pB(100,43) = 858,6347 MeV
Propriétés générales du noyau
6
énergie de liaison moyenne/nucléon
Ex
:
Ruthénium
et
Technécium
Ru
100
c
T
100
43
Ex
:
Ruthénium
et
Technécium
B(100,44) = 861,0676 MeV pB(100,44)/A = 8,6107MeV
B(100,43) = 858,6347 MeV pB(100,43)/A = 8,5863MeV
Ru
44
c
T
43
Δ(B/A) = 0,0244MeV
BPour comparer l’énergie de liaison/nucléon de noyaux voisins, on souhaite connaître
Δ(B/A) à 1% près [δΔ(B/A) / Δ(B/A)]
Sachant que cette énergie de liaison est déduite de la mesure de la masse atomique :
Δ(B/A) = (1/A )(B1–B
2) pδΔ(B/A) = (1/A) 2δM
B
δ
M
/M 10
7
B
δ
M
/M
~
10
-
7
énergie de liaison moyenne/nucléon : B(A,Z)/A
A
Z)(A,M
)MH)M((
A
Z
M
A
Z)(A,M
M
A
Z
1H)M(
A
Z
A
Z)B(A, atome
n
1
n
atome
n
1−−+=−
⎟
⎠
⎞
⎜
⎝
⎛−+= Δ
ΔΔΔ
Δ
ΔΔ
A
Z)(A,∆M
A
Z
0,7828,071
A
Z)B(A, atome
−−=
1
/
2
100%