Télécharger

STRUCTURE DE L'ATOME
Exercice 1
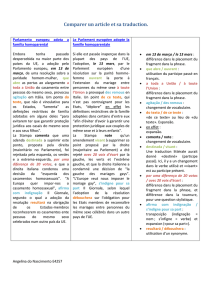
Indiquer le nombre de protons, de neutrons et d'électrons qui participent à la composition des
structures suivantes : 818O, 818O2- , 1735CL-, 2656FE2+, 2040Ca, 2040Ca2+, 1632S2-, 1327Al3+, 2859Ni,
2759CO.
nombr
e de
protons
nombre
de
neutrons
nombre
d'électrons
818O 8 10 8
818O2- 8 10 10
1735CL-17 18 18
2656FE2+ 26 30 24
2040Ca 20 20 20
2040Ca2+ 20 20 18
1632S2- 16 16 18
1327Al3+ 13 14 10
2859Ni 28 21 28
2759CO 27 22 27
Exercice 2
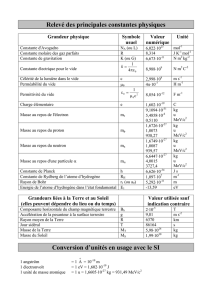
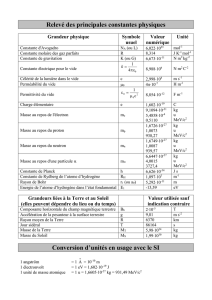
Les masses du proton, du neutron et de l'électron sont respectivement de 1, 6726485.10-24, 1,6749543.10-
24 et 9,109534.10-28 g.
a) Définir l'unité de masse atomique (uma). Donner sa valeur en g avec les mêmes chiffres significatifs
que les masses des particules du même ordre de grandeur.
Unités de masse atomique (u.m.a) : 1/12 de la masse d'un atome 612C.
1 u.m.a = 1/12 . 12.10-3 / N = 1.6605654 . 10-24
b) Calculer en uma, et à 10-4 près, les masses du proton, du neutron et de l'électron.
mp = 1,00728 uma
mn = 1,00867 uma
me = 5,4858 uma

d) Calculer d'après la relation d'Einstein (équivalence masse-énergie) le contenu énergétique d'une uma
exprimé en MeV.
ΔE = Δmc2 = 1,4945 . 10-10 J = 933 MeV
Exercice 3
Considérons l'élément phosphore P (isotopiquement pur, nucléide 1531P):
a) Déterminer, en uma et avec la même précision que précédemment, la masse du noyau, puis celle de
l'atome de phosphore.
15 . mp + 16 . mn = 5,1889447 . 10-23 g = 31,2477 uma
Pour l'atome :
15 me = 1,36643 . 10-26 g
15 . mp + 16 . mn + 15 me = 5,190266 . 10-23 = 31,2560 uma
b) Est-il raisonnable de considérer que la masse de l'atome est localisée dans le noyau ?
Oui
me << mp + mn
c) Calculer la masse atomique molaire de cet élément.
ma .N = 31,2562 g.mol-1
d) La valeur de la littérature est de 30,9738 g. mol-1. Que peut-on en conclure ?
Δm = | 30,9738 - 312562 | 0,2828 g.mol-1
Le système perd de l'énergie quand il se forme.
Exercice 4
Deux isotopes constituent l'élément brome: 79Br (50,54% et 78,9183 g. Mol-1) et 81Br (49,46% et
80,9163 g. mol-1). Déterminer sa masse atomique molaire.
78.9183 .50.54/100 + 80.9163 . 49.46/100 = 79.9065 g.mol-1
Exercice 5
Compléter la réaction de fission :
92235U +??n → ???* →?136 La + 35?Br + 3 01?.
92235U +01n → 92236U* →57136 La + 3597Br + 3 01n.
a) Sachant qu'une fission de ce type est susceptible de libérer 200 MeV environ, calculer la vitesse de
combustion de ce matériau fissile dans un réacteur nucléaire fonctionnant à la puissance de 100MW.

100 MW = 100.106 J.s-1
1 reaction élémentaire fournit 200 MeV = 200 . 106 . 1,6 .10-19 = 3,2 .10 -11J
nombre de fisson par secondes : 3.108 / (3,2.10-11) = 3,125 . 1018
b) Combien utiliserait-on d'uranium naturel par an si l'on suppose que l'on ne peut traiter que 5% de son
contenu en isotope 235 avant de le remplacer en totalité ?
Proportion isotopique 0,72 %.
En 1 an si on peut traiter 100 % 9,855 . 1025 fission
5 % peut être traité 9,855 . 1025. 100 / 5 = 1,971 . 1027 fissions
1,971 . 1027. 100 / 0,72 = 2,7375 . 1029
2,7375 . 1029 . (235/N) . 10-3 = 1,068 . 105 kg = 106,86 T
Exercice 6
L'eau courante contient un isotope lourd de l'hydrogène appelé tritium (3H). À partir du moment où cet
élément ne participe plus au cycle de la vie, sa concentration diminue au cours du temps. Les nombres de
coups par minute enregistrés par un compteur de particules pour l'eau courante et un échantillon de
whisky sont respectivement de 130 et de 60.
Sachant que la période du tritium est T = 12,3 années, estimer l'âge du whisky.
Remarque : chaque coup correspond à 1a désintégration d'un atome de tritium.
On prendra ln 2 = 0,693.
ln Ao/A = ln2/ T t
ln 130/60 = ln 2/12.3 t
t = (ln 130/60) . (12.3/ln2) = 13,72 ans
Exercice 8
Établir l'expression de la constante de Rydberg à partir de celles de l'énergie totale de l'électron dans la
théorie de Bohr et de la fréquence du spectre d'émission dans le cas de l'hydrogène. Calculer sa valeur.
1
/
3
100%