Aspect corpusculaire de la lumière

Optique 3 Aspect corpusculaire de la lumière
Lycée Polyvalent de Montbéliard - Physique-Chimie - TSI 1 - 2016-2017
Contenu du programme officiel :
Notions et contenus Capacités exigibles
Dualité onde-particule pour la lumière et la matière.
Énergie d’un photon et d’un flux de photons.
- Interpréter les échanges d’énergie entre lumière et matière à l’aide du
modèle corpusculaire de la lumière.
- Quantifier l’énergie reçue par une cellule photovoltaïque.
- Exploiter des données techniques de performances d’une diode électro-
luminescente (efficacité énergétique, durée de vie, température de couleur,
IRC...).
En gras les points devant faire l’objet d’une approche expérimentale.
Table des matières
1 La dualité onde-corpuscule 1
1.1 Deux modèles pour la lumière. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 1
1.2 Lesphotons............................................... 2
1.3 La puissance lumineuse . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 2
1.4 Etlamatière? ............................................. 3
2 Interactions lumière-matière 3
2.1 Les niveaux électroniques des atomes . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 3
2.2 Les modes d’échanges d’énergie . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 4
3 Lumière et semi-conducteurs 5
3.1 Les matériaux semi-conducteurs . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 5
3.2 Les cellules photovoltaïques . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 6
3.3 Les diodes électroluminescentes (LED) . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 6
1 La dualité onde-corpuscule
1.1 Deux modèles pour la lumière
IUn peu d’histoire...
En 1839, une expérience d’Antoine Becquerel et son fils Alexandre Edmond Becquerel, présentée à
l’Académie des Sciences, permet d’observer pour la première fois que si on illumine une électrode d’un dis-
positif composé de deux électrodes identiques plongées dans un électrolyte, il peut apparaître une différence
de potentiel (ou tension électrique) entre ces deux électrodes d’environ 10−4V.
En 1886, Heinrich Hertz, découvre que cet effet dépend de l’intensité lumineuse. Il découvre « l’effet
photoélectrique ». Lumière et matière peuvent interagir. Dans certaines conditions, la lumière absorbée par
la matière libère un électron, et donc un courant électrique. La lumière porte donc une certaine quantité
d’énergie qu’elle cède à l’électron qui se met en mouvement.
Matière
lumière
électron
Fig. 1 – Schéma de l’effet photoélectrique
Maxime Champion - www.mchampion.fr 1/7

Optique 3 : Aspect corpusculaire de la lumière Maxime Champion
En 1900, Max Planck, cherchant à expliquer le spectre d’un « corps noir » (spectre des corps chauffés),
émet l’hypothèse que les échanges d’énergie entre la lumière et la matière ne peuvent se faire par paquets
d’énergie : les quantas. Le plus petit paquets d’énergie échangé avec une radiation de fréquence νvaut :
∆E=hν où hest la constante de Planck (prix Nobel en 1918).
En 1905, Albert Einstein va plus loin. Pour expliquer l’effet photoélectrique, il propose un modèle
corpusculaire de la lumière : la lumière serait constituée de petits « grains d’énergie » qui transportent
chacun une énergie ∆E=hν (prix Nobel en 1921).
En 1913, Niels Bohr, qui cherche à comprendre la stabilité des atomes, introduit l’idée que l’énergie
des électrons dans un atome ne peut prendre que certaines valeurs particulières, appelées niveau d’énergie
(prix Nobel en 1922).
C’est en 1926 que le « grain de lumière » est baptisé photon par Gilbert Lewis.
Au final, la lumière se comporte comme une onde (interférences, diffraction...) et comme
une particule.
ILe radiomètre de Crookes
Expérience 1 : Le radiomètre de Crookes consiste en une ampoule sous vide partiel, dans
laquelle on a disposé un système rotatif constitué d’un axe de métal sur lequel peut tourner un
ensemble de quatre ailettes de mica dont chacune a une des faces noircie au noir de fumée et
l’autre argentée. Exposées à la lumière, ces ailettes se mettent à tourner et d’autant plus vite
que la lumière est forte.
1.2 Les photons
Définition. La lumière correspond au déplacement de particules appelées photons.
Ils sont sans masse : mphoton = 0 (rigoureusement).
Ils se déplacent toujours à la vitesse de la lumière (cdans le vide et c/n dans les milieux).
Ils portent l’énergie
Ephoton =hν =hc
λ
avec νleur fréquence (correspondant à l’onde lumineuse) et h= 6.62 ×10−34 J·sla constante de
Planck.
Application 1 : Dans le vide, calculer l’énergie portée par une photon bleu.
Les ordres de grandeurs des énergies des photons en Joule sont très très faibles. Pour manipuler ces
énergies plus facilement, on définit une nouvelle unité.
Définition. L’électronvolt est une unité d’énergie donnée par la charge de l’électron emultipliée par la
tension 1 V. On a donc
1 eV = 1.6×10−19 J.
Remarque : On remarque que la valeur numérique est la même que celle de la charge de
l’électron. Cela est dû à la définition de cette unité.
Application 2 : Donner l’énergie portée par un photon bleu en électronvolt.
1.3 La puissance lumineuse
Considérons une lumière monochromatique de fréquence νcontenant une certaine énergie ∆Eémise
pendant le temps ∆t. Par définition, la puissance est l’énergie par unité de temps, d’où
P=∆E
∆t.
Par ailleurs, le nombre de photons traduit l’intensité de la lumière. Si on note Nle nombre de photons
contenu dans cette lumière, on
∆E=Nhν .
Généralement, le nombre de photons Nest très grand devant 1015.
2/7

Optique 3 : Aspect corpusculaire de la lumière Maxime Champion
Propriété. La puissance lumineuse d’une lumière monochromatique de fréquence νcontenue dans un
faisceau de photon vaut
P= Φhν
avec Φ = N
∆tle flux de photons, c’est-à-dire le nombre de photons émis par unité de temps.
Application 3 : Vérifier l’homogénéité de la formule précédente.
1.4 Et la matière ?
La figure 2 représente une interférence de matière. Les particules sont projetées sur une surface composée
de deux trous et on observe une figure d’interférence sur l’écran derrière. Si on bouche un des trous, la
figure est radicalement différente. Au final, pour observer ces interférences, les particules doivent « passer
par les deux trous ». Autrement dit, la particule se comporte aussi comme une onde.
Fig. 2 – Figure d’interférences de particules de phthalocyanine. Technique de microscopie en fluorescence
montrant des franges d’interférences produites par un réseau de diffraction. Les franges mesurent environ 0,1
mm d’épaisseur. Ces extraits en temps réel correspondent pour les premières images à 2,20 minutes puis 40 (d)
et enfin 90 (e). ©Juffmann et al./Nature Nanotechnology
Pour quantifier les effets ondulatoires d’une particule de masse met de vitesse v, on associe à celle-ci
la longueur d’onde de de Broglie
λ=h
mv .
Si une particule rencontre un obstacle d’une taille comparable à λ, des effets ondulatoires apparaissent.
En prenant des ordres de grandeurs typiques, cette longueur d’onde est de l’ordre de 10−34 m pour un
coureur et 10−34 m pour une balle de tennis. Pour les objets macroscopiques usuels, cette longueur d’onde
est tellement faible qu’il est impossible de rencontrer des phénomènes ondulatoires.
Par contre, pour des objets microscopiques, la longueur d’onde en ordre de grandeur vaut 10−6m pour
des neutrons froids et 10−11 m pour des électrons allant à c/10. Cette ordre de grandeurs sont accessibles,
et permettent même de sonder la matière et les atomes (de taille ≈10−10 m).
2 Interactions lumière-matière
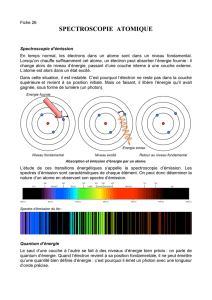
2.1 Les niveaux électroniques des atomes
Historiquement, la vision qu’on avait des atomes était du type planétaire. Le modèle de l’atome d’hy-
drogène de Bohr est un électron qui gravite autour d’un proton, comme la Lune autour de la Terre. Ce
modèle pose un problème majeur. En effet, toute particule chargée en mouvement émet un rayonnement
électromagnétique, et donc perd de l’énergie. Ce modèle planétaire est donc impossible, car l’électron serait
censé s’écraser sur le proton en quelques fractions de secondes.
3/7

Optique 3 : Aspect corpusculaire de la lumière Maxime Champion
Propriété. L’énergie des électrons autour d’un atome est quantifiée. On représente ces énergies par des
niveaux sur un axe. Le premier niveau E0est appelé l’état fondamental et les niveaux supérieurs sont
les états excités. Lorsque l’électron est dans le niveau fondamental, l’atome est dit au repos.
E
E0: état fondamental
•
E1: premier état excité
E2
Fig. 3 – L’électron est situé sur le premier niveau d’énergie et possède une énergie E0fixée.
Exemple 1 : Pour l’atome d’hydrogène, les niveaux d’énergies sont données par la formule
En=−E1
n2avec E1= 13.6 eV et n>1.
2.2 Les modes d’échanges d’énergie
Les échanges entre la lumière et la matière sont de trois types. Dans tous les cas, il s’agit d’une conversion
d’énergie lumineuse en énergie de l’électron.
IL’absorption
Propriété. Un photon incident d’énergie hν arrive sur un atome dont un électron est sur le niveau d’énergie
E. S’il existe un autre niveau d’énergie E0tel que
∆E=E0−E=hν
alors le photon est absorbée par l’atome et l’électron passe au niveau d’énergie excité E0.
E
•e−
E0
photon absorbé
Fig. 4 – Si l’énergie du photon hν est égale à E0−E, le photon est absorbée et l’électron passe sur l’état
excité E0.
Ainsi, seules certaines longueurs d’ondes très précises peuvent être absorbées par la matière. Ces lon-
gueurs d’ondes dépendent des atomes.
IL’émission spontanée
Propriété. Soit un électron sur un niveau d’énergie excité E0et El’énergie d’un état inférieur. Spontané-
ment, l’atome peut se désexciter et l’électron passe de l’état d’énergie E0à l’état E. Un photon est émis
de fréquence νdonnée par
∆E=E0−E=hν .
E
E0•e−
photon émis
Fig. 5 – En se désexcitant spontanément, l’électron change de niveau d’énergie. L’énergie perdue dans l’atome
est convertie dans un photon d’énergie E0−E.
4/7

Optique 3 : Aspect corpusculaire de la lumière Maxime Champion
Ainsi, seules certaines longueurs d’ondes très précises peuvent être émises par un atome. Ces longueurs
d’ondes sont la signature de l’atome.
Expérience 2 : TP 07 - Spectrométrie
IL’émission stimulée
Propriété. Soit un électron sur un niveau d’énergie excité E0et El’énergie d’un état inférieur. Un photon
incident d’énergie hν =E0−Earrive. De façon stimulée, deux photons de même énergie et ayant les
mêmes propriétés que le photon incident sont émis et l’électron descend d’un niveau d’énergie.
E
E0•e−
2 photons identiques sont émisphoton incident
Fig. 6 – Un photon d’énergie hν =E0−Earrive sur l’atomes. Deux photons identiques au photon incident
sont réémis et l’électron descend d’un niveau d’énergie.
Ce phénomène est la base de la lumière laser. C’est un phénomène que l’on ne retrouve quasiment
qu’artificiellement.
IApplication à l’atome d’hydrogène
Chaque atome émet et absorbe donc uniquement certaines raies particulières. Pour l’atome d’hydrogène,
les énergie accessibles pour les photons émis et absorbés sont donc ∆E=E11
n2−1
p2avec net pdes
entiers. Cela conduit au spectre d’émission de la figure 7. Ce phénomène ne peut se faire qu’avec ces photons
particulier, comme cela est modélisé dans l’animation [1].
Fig. 7 – Le spectre d’émission de l’Hydrogène
3 Lumière et semi-conducteurs
3.1 Les matériaux semi-conducteurs
Les matériaux semi-conducteurs sont à mi-chemin entre les isolants et les conducteurs. Le plus utilisé
est le silicium.
Au lieu d’avoir simplement des niveaux d’énergie, les semi-conducteurs ont des bandes d’énergie
(figure 8). À faible énergie, les électrons sont dans la bande de valence et le matériau se comporte comme
un isolant. À haute énergie, les électrons franchissent le gap et se trouvent dans la bande de conduction, le
matériau se comporte comme un conducteur. Pour les matériaux usuels, l’énergie de gap est de l’ordre de
l’électronvolt.
5/7
 6
6
 7
7
1
/
7
100%