L`achalasie signifie en grec un défaut d`ouverture, c`est un trouble

Traitement coeliochirurgical
de l’achalasie oesophagienne
1
INTRODUCTION

Traitement coeliochirurgical
de l’achalasie oesophagienne
2
L’achalasie signifie en grec un défaut d’ouverture. C’est un trouble moteur
primitif rare de l’œsophage, caractérisé par un apéristaltisme oesophagien et une
absence de relaxation du SIO de l’oesophage en réponse à la déglutition (1).
Malgré les nombreuses études réalisées depuis le premier cas décrit par Sir
Thomas Willis en 1674(2), l’achalasie demeure d’étiologie inconnue. Plusieurs
hypothèses étiopathogéniques ont été avancées mais sans certitude à savoir
l’obstruction de la jonction oesogastrique, l’infection virale, la dégénérescence
neuronale et les maladies auto immunes (3) .
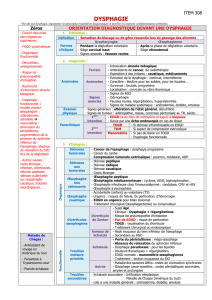
Le diagnostic de l’achalasie est orienté par les signes cliniques et confirmé par
les données endoscopiques, radiologiques et surtout manométriques. Le tableau
clinique est dominé par la dysphagie ainsi que par d’autres symptômes moins
fréquents.
Le but du traitement de l’achalasie est de supprimer l’obstacle fonctionnel du
bas œsophage en réduisant la pression du SIO sans pour autant induire des
complications (4).
Du fait de l'efficacité limitée et éphémère des substances pharmacologiques
notamment les dérivés nitrés et les inhibiteurs calciques, les principales options
thérapeutiques actuelles reposent sur la dilatation mécanique réalisée depuis 1674
par Sir Thomas Willis, l’injection de toxine botulinique pratiquée par Pasricha en 1993
et la cardiomyotomie de Heller. Cette méthode fût décrite pour la première fois en
1913 par Sir Ernest Heller qui a réalisé une double myotomie antérieure et
postérieure. Des modifications ont été apportées à cette technique par Groeveldt en
1918 et Zaajer en 1923 pour aboutir à l'intervention de Heller actuelle limitée à une
myotomie antérieure (4).

Traitement coeliochirurgical
de l’achalasie oesophagienne
3
Ce n’est qu’en 1991 que la myotomie de Heller, initialement réalisée par
laparotomie ou thoracotomie, est remise à l’honneur grâce à la coeliochirurgie
permettant d’éviter les complications de la chirurgie ouverte et d’améliorer le confort
post-opératoire.
Le but de notre étude est de rapporter à travers une série de cas les résultats
à court et à moyen terme de la cardiomyotomie de Heller par voie coelioscopique,
tout en précisant les avantages et les inconvénients de cette technique.

Traitement coeliochirurgical
de l’achalasie oesophagienne
4
MATERIEL ET METHODE

Traitement coeliochirurgical
de l’achalasie oesophagienne
5
Notre étude rétrospective a porté sur 22 cas d’achalasie ayant bénéficié d’une
cardiomyotomie de Heller par voie coelioscopique colligés au sein de la clinique
chirurgicale C de l’Hôpital IBN SINA de Rabat sur une période allant de Décembre
2000 à juin 2008.
Il faut noter que durant cette même période 27 cas d’achalasie ont été
recensés ; Nous avons exclu de notre étude deux patients ayant bénéficié d’une
chirurgie conventionnelle et trois malades dont le suivi ne dépasse pas 6 mois.
Les renseignements cliniques, radiologiques, endoscopiques et manométriques
sont recueillis à partir des dossiers médicaux des patients.
Pour cela nous avons établi une fiche d’exploitation pour nos malades. (Voir
annexe 1).
Les paramètres étudiés sont :
L’identité :
- Age ;
- Sexe ;
- Antécédents.
le délai d’apparition des signes cliniques.
la symptomatologie clinique.
les données endoscopiques.
les données radiologiques et la stadification.
les données manométriques en précisant la pression de repos du SIO, sa
relaxation en réponse à la déglutition et les caractéristiques des
contractions oesophagiennes.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
1
/
72
100%