Physique/Chimie - 2nde - Conservation des éléments

© PIERRON 2011 Conservation des éléments chimiques (page 1)
Document du professeur 1/5
Programme : BO n° 4 du 29 avril 2010
L’UNIVERS
NOTIONS ET CONTENUS COMPÉTENCES ATTENDUES
LES ELEMENTS CHIMIQUES PRESENTS DANS L’UNIVERS : au sein des étoiles se forment
des éléments chimiques qui font partie des constituants de l’Univers. La matière qui nous entoure
présente une unité structurale fondée sur l'universalité des éléments chimiques.
Éléments chimiques.
Caractérisation de l’élément par son
numéro atomique et son symbole.
Savoir que le numéro atomique caractérise l’élément.
Mettre en œuvre un protocole pour identifier des ions.
Pratiquer une démarche expérimentale pour vérifier la
conservation des éléments au cours d’une réaction chimique.
Pré requis :
o Réaction entre le fer et l’acide chlorhydrique
o Test de reconnaissance du dihydrogène
Mots-clé
o Elément chimique
o Conservation
Liste de matériel :
Professeur
o Oxyde de fer
o Poudre d’aluminium Ref. : 01064250
Poste élève
o Portoir Ref. : 00025
o 6 Tubes à essai Ref. : 08666
o Spatule Ref. : 06655
o Poudre de fer (limaille) Ref. : 01415250
o Petit flacon compte goutte d’acide chlorhydrique 5 mol.L-1 Ref. : 01012980
o Petit flacon compte goutte de solution de soude 5 mol.L-1 Ref. : 01819980
o Trompe à vide Ref. : 07386
o Tube à vide Ref. : 00861
o Fiole à filtrer Ref. : 06586
o Cône d'étanchéité Ref. : 04709
o Entonnoir de Büchner Ref. : 06852
o Filtre Ref. : 07386
o Eponge
o Goupillon Ref. : 00031
Physique – Chimie
CONSERVATION DES ELEMENTS CHIMIQUES
Niveau 2de
THEME : L’UNIVERS

© PIERRON 2011 Conservation des éléments chimiques (page 2)
Document du professeur 2/5
Remarques, astuces
o Dans le cadre de ce thème, il peut être intéressant de choisir un élément chimique majoritaire sur notre
planète. En moyenne, la composition chimique (en masse) de la Terre est:
- 34,6% Fer
- 29,5% Oxygène
- 15,2% Silicium
- 12,7% Magnésium
- 2,4% Nickel
- 1,9% Soufre
- 0,05% Titane
Le fer est aussi l’élément le plus abondant des étoiles géantes rouges d’où le choix retenu.
Les élèves ont déjà rencontré au collège la réaction entre le fer et l’acide chlorhydrique. Ils
savent qu’il se produit un dégagement de dihydrogène dont ils connaissent le test de
caractérisation :
- « Aboiement » caractéristique en présence d’une flamme lorsque le tube contient encore du
dioxygène.
- Sinon petite détonation puis combustion sans bruit.
o L’expérience d’aluminothermie ne sera pas faite par les élèves : c’est une activité professeur.
Il est cependant recommandé, si l’équipement de la salle de classe le permet, de la filmer avec
une caméra qui renvoie l’image sur un poste de télévision ou un écran afin que toute la classe
puisse la suivre.
Les élèves viendront ensuite voir de plus près le produit obtenu.
o Rappeler impérativement aux élèves les dangers présentés par l’acide chlorhydrique et la soude
dont les fiches sécurité sont ici jointes :
Prolongements possibles :
L’aluminothermie est une réaction d’oxydoréduction très exothermique qui est utilisée par exemple pour le
soudage des rails de chemin de fer. C’est principalement l’oxyde de fer Fe2O3 qui est utilisé, même si la réaction
pourrait être effectuée à partir d’autres oxydes métalliques.
Les oxydes de fer sont nombreux et variés, on rencontre notamment :
L’oxyde de fer (II) : Fe O
L’oxyde de fer (III) : Fe2O3
L’oxyde magnétique : Fe3O4
Les oxydes de fer donnent des couleurs particulières, souvent rougeâtres, au sol qui les contient. Ils sont également
utilisés comme pigments.
Acidechlorhydrique>25%
R34:Provoquedesbrûlures
R37:Irritantpourlesvoiesrespiratoires
S26:encasdecontactaveclesyeux,laver
immédiatementetabondammentavecdel’eauet
consulterunspécialiste
S45:Encasd’accidentoudemalaiseconsulter
immédiatementunmédecin(sipossibleluimontrer
l’étiquette)
Soude(hydroxydedesodium)
R35:Provoquedegravesbrûlures
S26:encasdecontactaveclesyeux,laver
immédiatementetabondammentavecdel’eauet
consulterunmédecin
S37/39:porterdesgantsappropriésetunappareil
deprotectiondesyeux/duvisage
S45:Encasd’accidentoudemalaiseconsulter
immédiatementunmédecin(sipossibleluimontrer
l’étiquette)

© PIERRON 2011 Conservation des éléments chimiques (page 3)
Document du professeur 3/5
Objectifs : - Pratiquer une démarche expérimentale pour vérifier la conservation des éléments
au cours d’une réaction chimique.
- Elaborer un cycle du fer.
Cette séance expérimentale s’appuiera sur l’élément « fer » qui est le plus important des éléments constituant
notre planète.
L’élément fer peut exister sous différents états : Métal [Fe] - Oxyde solide [Fe2O3 entre autres oxydes] -
précipités [Fe (OH) 2, Fe (OH) 3] - ions en solution [ions fer(II)] …
Vous devez compléter les lignes de votre feuille de T.P. au fur et à mesure de vos activités
expérimentales en précisant l’état (métal, solide, ions en solution, précipité) sous lequel vous
rencontrez l’élément fer ainsi que sa couleur.
I. ACTIVITÉ ÉLÈVE
Dans un tube à essai, verser une spatule de poudre de fer puis, avec précaution, environ 5 mL d’acide
chlorhydrique à 5,00 mol.L-1. Noter vos observations pendant que l’expérience se déroule.
Le tube s’échauffe, on observe une effervescence, la solution prend une couleur verdâtre
Laisser la réaction se poursuivre durant 5 minutes minimum puis indiquer sous quelle forme se
trouve maintenant l’élément fer.
Le fer, métal de couleur grise, attaqué par l’acide chlorhydrique, donne naissance à des ions fer (II),
Fe2+, donnant une couleur verdâtre à la solution
Filtrer et recueillir dans un tube propre le filtrat, y ajouter délicatement environ 5mL d’une solution
d’hydroxyde de sodium à 5,00 mol.L-1.
Noter vos observations.
On observe l’apparition d’un précipité vert
Sous quelle forme se trouve maintenant l’élément fer ?
Le fer se trouve sous la forme d’un précipité vert d’hydroxyde de fer (II), Fe(OH)2.
Filtrer le contenu du tube à essai et observer le contenu du papier filtre à la fin de la filtration.
Noter l’aspect et la couleur de ce qu’il contient.
On observe la formation d’un précipité de couleur rouille d’hydroxyde de fer (III), Fe(OH)3.
Lorsque la filtration est terminée, poser votre papier filtre sur un autre papier filtre pour absorber le
liquide et étaler soigneusement le composé obtenu. Placer le précipité dans une étuve à 80°C.
Physique – Chimie
Thème : L’univers
CONSERVATION DES ELEMENTS CHIMIQUES
Nom :
Prénom :
Classe :
Date :

© PIERRON 2011 Conservation des éléments chimiques (page 4)
Document du professeur 4/5
Quelle est le rôle de l’étuve ?
L’étuve permet de déshydrater l’hydroxyde de fer (III)
Décrire le contenu du papier filtre
On obtient une poudre solide rouge-marron que l’on peut recueillir à l’aide d’une spatule
Sous quelle forme se trouve maintenant l’élément fer ?
L’élément fer se trouve sous la forme d’oxyde de fer (III), Fe2O3.
II. ACTIVITÉ PROFESSEUR
Un mélange de poudre d’oxyde de fer (III), tout à fait semblable à celle obtenue dans l’étuve et de
poudre d’aluminium, est placé sur une brique réfractaire.
La réaction entre ces deux composés est amorcée par la combustion d’un ruban de magnésium.
Observer attentivement l’expérience et noter vos conclusions en indiquent la nature du corps solide
obtenu :
Il se forme un métal incandescent qui devient gris en refroidissant et qui est attiré par un aimant.
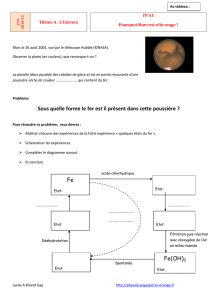
III. CONCLUSION
Préciserez dans le tableau ci-dessous, la formule, l’état et la couleur sous laquelle vous avez
rencontré l’élément fer.
En vous aidant des photographies ci-dessus et des observations expérimentales précédentes
(élève et professeur), élaborer le cycle de l’élément fer en partant du métal fer, Fe :
Fe Fe2O3 Fe (OH)3 Fe2+ Fe2O3, H2O Fe (OH)2
Solide
Métal Solide
Oxyde Poudre
Précipité Liquide
Ions en solution Solide
Oxyde hydraté Aspect gélatineux
Précipité
Gris Rouge Rouille Verdâtre Marron foncé Vert

© PIERRON 2011 Conservation des éléments chimiques (page 5)
Document du professeur 5/5
Complétez ensuite les phrases ci-dessous :
EXERCICE D’APPLICATION :
Le parc national du Grand Canyon est situé dans le nord-ouest de
l'Arizona. Le Grand Canyon a été creusé par le fleuve Colorado.
Depuis 1919, le parc est un territoire protégé de 4 927 km² qui fait
partie du patrimoine mondial de l’Humanité depuis 1979.
Sous quelle forme se trouve l’élément fer dans le grand canyon ?
Utiliser les résultats expérimentaux pour argumenter votre réponse.
Les parois ont une couleur rouge caractéristique des oxydes de fer.
Il s’agit d’un solide non hydraté, il ne peut donc s’agir que de
l’oxyde de fer Fe2O3
Il est possible, par une succession de réactions chimiques, de retrouver le métal fer de départ :
cela constitue un cycle.
L’élément fer, Fe, est présent dans chacun des composés rencontrés au cours des réactions
chimiques : il y a donc conservation des éléments lors des transformations chimiques.
1
/
5
100%