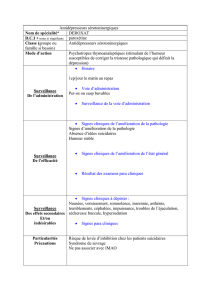
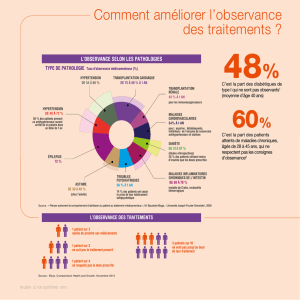
THÈSE pour le DIPLÔME D`ÉTAT DE DOCTEUR EN PHARMACIE

UNIVERSITÉ DE NANTES
UFR SCIENCES PHARMACEUTIQUES ET BIOLOGIQUES
____________________________________________________________________________
ANNÉE 2015 N° 004
THÈSE
pour le
DIPLÔME D’ÉTAT
DE DOCTEUR EN PHARMACIE
par
Cécile Duval
Née le 02 janvier 1992, à Vannes (56)
-----------------------------------------
Présentée et soutenue publiquement le 27 mars 2015
Expertise pharmacologique en psychiatrie: un regard spécialisé
pour optimiser la prise en charge médicamenteuse des troubles
de l’humeur complexes
Président : Madame Virginie FERRE, Professeur de Virologie – Praticien Hospitalier
Directrices de thèse : Madame Anne SAUVAGET, Psychiatre - Praticien Hospitalier
Madame Caroline VICTORRI-VIGNEAU, Maitre de Conférence des
Universités de Pharmacologie Clinique – Praticien Hospitalier
Membres du jury : Monsieur Samuel BULTEAU, Psychiatre - Chef de Clinique
Monsieur Cyrille MOREAU, Docteur en Pharmacie
Monsieur Jean-Marie VANELLE, Professeur de Psychiatrie – Praticien
Hospitalier

Remerciements
Je tiens tout d’abord à remercier toutes les personnes qui ont contribué à l’élaboration de
cette thèse et qui acceptent de juger ce travail
Caroline Victorri-Vigneau,
Je souhaite vous exprimer ici mes plus sincères remerciements. Vous
accompagnée dans la mise en place de ces consultations pharmacologiques et dans la
rédaction de cette thèse mais vous avez également fait preuve
la chance de travailler de
n
Anne Sauvaget,
Je vous remercie . Vous avez enrichi mon stage et ce
de
Madame Le Doyen Virginie Ferré,
, au
sein de votre laboratoire ou lors de conseils universitaire, vous avez toujours placé
ssite
préoccupations. Je vous exprime ici mon profond respect.
Monsieur le Professeur Jean-Marie Vannelle,
Mon stage au sein de votre service a été très formateur. accordé votre
confiance lors de la mise en place du projet, vous acceptez de prendre place
dans ce jury ; soyez assuré de mes vifs remerciements et de mon plus grand respect.
Samuel Bulteau,
Je vous remercie pour la qualité de votre accueil durant ce stage et pour vos qualités
humaines. Complétant mon approche pharmaceutique, vous avez su me faire découvrir des
aspects passionnants de la psychiatrie.
M. Moreau
dans votre officine. Je vous remercie pour votre accompagnement dans ces derniers
moments de formation.
Anne Pichot et Pierre Valrivière,
J avec vous : sans vous, ce travail aurait été beaucoup
plus difficile. Je vous remercie pour votre écoute, votre dynamisme et votre bonne humeur.

Je souhaite également remercier ceux qui m’ont aidé à être le pharmacien que je deviens
ont su nous transmettre leur passion et leur savoir.
le terrain : M. et Mme Boëdec, M. Guieu, Mme Moreau, M. Patin, ainsi que leurs équipes.
vos pas.
ème année AHU :
l rticulièrement Brigitte Maulaz, le
.
Le service des relations internat
Biologiques de Nantes. Au-delà de es
de découvrir un autre visage de la pharmacie.
Le Maisonneuve Rosemont : les pharmaciens,
les assistants techniques et les étudiants
.
Le professeur Hildgen et son équipe (Axe Formulation et Analyse du médicament du
laboratoire de nanotechn
de Montréal), notamment Valéry Aoun pour notre
collaboration.
Tous les professionnels de santé . Le travail en équipe est
.
Ensuite, je souhaite remercier ceux qui ont fait de ces années d’étude ce qu’elles ont été et ce
qu’elles vont devenir
La promo 2015, et le groupe B en particulier,
La corpo, artenu, et ceux qui nous ont succédé.
Les membres de la team pharma,
Cosette, puisque le début de mes années pharma marque aussi le début de notre
amitié. Je sais que je peux continuer à compter sur ton soutien.
Enfin, je souhaite remercier ceux qui ont toujours été là
Mes parents, pour tout. Je vous aime
Mes : Sophie, Thomas et Claire et les nouveaux membres de la famille
: Franck, Angélique, Arsène et Archibald.

Table des matières
Liste des abréviations .................................................................................................................. I
Liste des figures ......................................................................................................................... III
Liste des tableaux ...................................................................................................................... IV
Liste des annexes ........................................................................................................................ V
Introduction ................................................................................................................................ 1
1 Partie théorique et clinique ............................................................................................... 3
1.1 .......................................................................... 3
1.1.1 Syndrome dépressif ................................................................................................ 4
1.1.1.1 Epidémiologie ............................................................................................... 4
1.1.1.2 Description clinique ...................................................................................... 4
1.1.1.3 Physiopathologie ........................................................................................... 5
1.1.2 Trouble bipolaire .................................................................................................... 5
1.1.2.1 Epidémiologie ............................................................................................... 5
1.1.2.2 Description clinique ...................................................................................... 6
1.1.2.3 Physiopathologie ........................................................................................... 7
1.1.3 ...................... 7
1.1.3.1 Troubles anxieux et phobiques ..................................................................... 7
1.1.3.1.1 Epidémiologie ........................................................................................... 7
1.1.3.1.2 Description ............................................................................................... 8
1.1.3.1.3 Physiopathologie ...................................................................................... 9
1.1.3.2 Les troubles addictifs .................................................................................... 9
1.1.3.2.1 Données épidémiologiques ...................................................................... 9
1.1.3.2.2 Description ............................................................................................. 10
1.1.3.2.3 Physiopathologie .................................................................................... 11
1.1.3.3 Une forme frontière : le trouble schizo-affectif ......................................... 12
1.2
12
1.2.1 Antipsychotiques .................................................................................................. 13
1.2.1.1 Antipsychotiques de 1ère génération .......................................................... 13
1.2.1.2 Antipsychotiques de 2ème génération ......................................................... 17
1.2.1.3 Formes retard ............................................................................................. 19
1.2.1.4 « Syndrome malin des neuroleptiques » .................................................... 20
1.2.1.5 Théorie intégrée de la schizophrénie et des antipsychotiques .................. 20
1.2.2 Antidépresseurs ................................................................................................... 22

1.2.2.1 Antidépresseurs imipraminiques ................................................................ 23
1.2.2.2 ISRS = Inhibiteurs Sélectifs de la Recapture de la Sérotonine .................... 24
1.2.2.3 IRSNa = Inhibiteurs de la Recapture de la Sérotonine et de la
Noradrénaline .............................................................................................................. 25
1.2.2.4 IMAO = Inhibiteurs de la Mono-Amine Oxydase ........................................ 26
1.2.2.4.1 Inhibiteur non sélectif ............................................................................ 26
1.2.2.4.2 Inhibiteur sélectif de la MAO-A .............................................................. 27
1.2.2.5 Autres antidépresseurs ............................................................................... 27
1.2.2.5.1 Les NASSA = Antidépresseurs spécifiques de la sérotonine et
noradrénaline ........................................................................................................... 27
1.2.2.5.2 Tianeptine (Stablon®) ............................................................................. 27
1.2.2.5.3 Agomélatine (Valdoxan®) ....................................................................... 28
1.2.3 Thymorégulateurs ................................................................................................ 29
1.2.3.1 Lithium ........................................................................................................ 29
1.2.3.2 Anticonvulsivants ........................................................................................ 31
1.2.3.3 Antipsychotiques......................................................................................... 32
1.2.4 Anxiolytiques ........................................................................................................ 32
1.2.4.1 Benzodiazépines ......................................................................................... 32
1.2.4.2 Antidépresseurs .......................................................................................... 35
1.2.4.3 Buspirone .................................................................................................... 35
1.2.4.4 Hydroxyzine ................................................................................................. 36
1.2.4.5 Etifoxine ...................................................................................................... 36
1.2.5 Hypnotiques ......................................................................................................... 37
1.2.5.1 Benzodiazépines ......................................................................................... 37
1.2.5.2 Apparentés aux benzodiazépines ............................................................... 38
1.3 .................................. 39
1.3.1 Psychothérapies ................................................................................................... 39
1.3.1.1 Psychothérapie de soutien ......................................................................... 40
1.3.1.2 Psychothérapie analytique ......................................................................... 40
1.3.1.3 Psychothérapies cognitives et comportementales ..................................... 40
1.3.1.4 Psychothérapies brèves .............................................................................. 40
1.3.2 Stimulation cérébrale ........................................................................................... 41
1.3.2.1 Electroconvulsivothérapie .......................................................................... 41
1.3.2.2 Stimulation magnétique transcranienne .................................................... 41
1.4 Recommandations ................................................................................................... 42
1.4.1 Prise en charge du syndrome dépressif ............................................................... 42
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
1
/
120
100%