RESUME DES CARACTERISTIQUES DU PRODUIT 1

RESUME DES CARACTERISTIQUES DU PRODUIT
1. DENOMINATION DU MEDICAMENT
Balsoclase Antitussivum 2,13 mg/ml solution buvable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
10 ml de solution buvable contient 21,3 mg de citrate de pentoxyvérine.
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Solution buvable
4. DONNEES CLINIQUES
4.1 Indications thérapeutiques
Le Balsoclase Antitussivum est indiqué dans le traitement symptomatique de la toux non
productive.
Le traitement sera poursuivi pendant la période la plus courte possible (quelques jours) et en
cas d'absence d'amélioration clinique il sera procédé à une réévaluation.
4.2 Posologie et mode d’administration
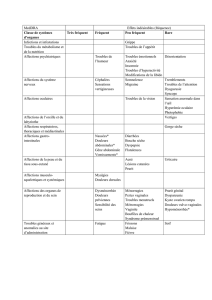
Posologie
La dose usuelle chez les adultes et enfants à partir de 6 ans est de 1,5 mg à 2,5 mg/kg/jour
exprimée en pentoxyvérine citrate.
Les doses journalières seront de préférence réparties en 3 à 4 prises.
Poids
(kg)
nombre de
cuillères/jour
6 ans
7 – 12 ans
15 à 25
kg
25 à 40
kg
1 à 4 cuillères à
dessert
2 à 5 cuillères à
dessert
adultes et
enfants de
plus de 12
ans
+ de 40
kg
3 à 6 cuillères à soupe
Chez l'adulte, la posologie maximale journalière conseillée en 3 ou 4 prises est de 2 à 2,5
mg/kg, exprimée en pentoxyvérine citrate. Chez l'enfant à partir de 6 ans, la posologie
journalière de 2,5 mg/kg ne sera pas dépassée.
Mode d’administration
Voie orale.
1

4.3 Contre-indications
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1
Le Balsoclase Antitussivum est contre-indiqué lorsque la toux est nécessaire pour
débarrasser les voies respiratoires de sécrétions anormalement abondantes, en cas
d'insuffisance respiratoire ou de dépression du SNC, dans la toux de l'asthmatique, en cas
de glaucome ou d'hypertrophie prostatique, ainsi qu’en cas d’insuffisance hépatique.
La prise du médicament est contre-indiquée chez la femme allaitante.
L’administration du Balsoclase Antitussivum est contre-indiquée chez les enfants de moins
de 6 ans.
4.4 Mises en garde spéciales et précautions d’emploi
En l'absence de données suffisantes, la prudence est recommandée lors de l'administration
à des patients atteints d'insuffisance rénale et chez les personnes âgées.
Chez les jeunes enfants ayant une prédisposition convulsive connue, une surveillance
s'impose pendant un traitement à la pentoxyvérine.
Ce médicament contient :
- du sorbitol (E420), il est contre-indiqué chez les patients présentant une intolérance
au fructose (maladie héréditaire rare)
- des parahydroxybenzoates (E216, E218) qui peuvent provoquer des réactions
allergiques éventuellement retardées.
4.5 Interactions avec d’autres médicaments et autres formes d’interactions
La pentoxyvérine peut potentialiser l’action des dépresseurs du système nerveux central,
parmi lesquels il faut citer l'alcool.
La pentoxyverine est principalement éliminée après métabolisation, mais les enzymes
responsables ne sont pas connues. Il est probable que l’administration concomitante de
substances connues pour être des inhibiteurs enzymatiques puisse augmenter les taux
plasmatiques de pentoxyverine.
4.6 Fécondité, grossesse et allaitement
Grossesse
Il n’existe pas de données ou il existe des données limitées sur l’utilisation de la
pentoxyvérine chez la femme enceinte.
Les études effectuées chez l’animal sont insuffisantes pour permettre de conclure sur la
toxicité sur la reproduction (voir rubrique 5.3).
Balsoclase Antitussivum n’est pas recommandé pendant la grossesse et chez les femmes
en âge de procréer n’utilisant pas de contraception.
Allaitement
Il n’existe pas de données suffisantes sur l’excrétion de la pentoxyvérine dans le lait
maternel.
Un risque pour les nouveaux-nés/nourrissons ne peut être exclu.
Balsoclase Antitussivum est contre-indiqué pendant l’allaitement (voir rubrique 4.3).
Fertilité
Aucune étude n’a été menée chez l’animal pour évaluer l’effet de la pentoxyvérine sur la
fertilité male ou femelle.
2

4.7 Effets sur l’aptitude à conduire des véhicules et à utiliser des machines
La conduite d'un véhicule et l'utilisation de machines ne semblent pas être affectées par
l'usage du Balsoclase Antitussivum aux doses thérapeutiques. Toutefois, la prudence est
requise chez des personnes particulièrement sensibles qui peuvent présenter de la
somnolence. Celle-ci peut être accrue par la prise simultanée d'autres médicaments
dépresseurs du système nerveux central et/ou l'alcool.
4.8 Effets indésirables
Possibilité de :
-Affections du système immunitaire : choc anaphylactique, réaction
anaphylactique, hypersensibilité.
-Affections psychiatriques : agitation, hallucination, état confusionnel.
-Affections du système nerveux : somnolence, convulsions.
-Affections oculaires : vision floue.
-Affections respiratoires, thoraciques et médiastinales : dyspnée, dépression
respiratoire.
-Affections gastro-intestinales : douleurs épigastriques, diarrhée, sécheresse de la
gorge et de la bouche, nausée, vomissement.
-Affections de la peau et du tissu sous-cutané : œdème angioneurotonique, prurit,
urticaire, rash.
-Troubles généraux et anomalies au site d’administration : fatigue.
Population pédiatrique : agitation, somnolence, convulsion, dépression respiratoire, ont été
rapportés chez l’enfant.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est
importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament.
Les professionnels de santé déclarent tout effet indésirable suspecté via
Belgique:
Agence fédérale des médicaments et des produits de santé
Division Vigilance
EUROSTATION II
Place Victor Horta, 40/40
B-1060 Bruxelles
Site internet: www.afmps.be
e-mail: [email protected]
Luxembourg :
Direction de la Santé – Division de la Pharmacie et des Médicaments
Villa Louvigny – Allée Marconi
L-2120 Luxembourg
Site internet : http://www.ms.public.lu/fr/activites/pharmacie-medicament/index.html
4.9 Surdosage
Symptômes
Le surdosage en pentoxyvérine se manifeste par de la somnolence, des nausées et des
effets atropiniques (rétention urinaire, xérostomie, glaucome, agitation, hallucination, état
confusionnel, convulsions, vision floue…).
Une dépression respiratoire et du SNC peuvent également survenir en cas de surdosage, en
particulier chez les enfants (voir rubrique effets indésirables).
3

Traitement
Il n'existe pas d'antidote spécifique.
L'induction de vomissements et l'usage de charbon actif sont des mesures classiques en cas
d'intoxication. Ils n'ont de sens que s'ils sont appliqués rapidement après l'ingestion. Il
convient de respecter les contre-indications habituelles et notamment de s'abstenir d'induire
des vomissements chez des patients inconscients.
En cas de surdosage, la surveillance des fonctions respiratoires et cardio-vasculaires
s'impose en milieu hospitalier.
5. PROPRIETES PHARMACOLOGIQUES
5.1 Propriétés pharmacodynamiques
Classe pharmacothérapeutique : antitussifs, code ATC : R05DB05
La pentoxyvérine, principe actif du Balsoclase Antitussivum, est un dépresseur du centre de
la toux, qui appartient au groupe des antitussifs non narcotiques; aucune forme de
dépendance n'a été signalée; en plus de son action centrale, elle a des propriétés
anesthésiques locales, qui insensibilisent la muqueuse aux agents irritants.
L'action anticholinergique est négligeable aux doses thérapeutiques; elle se manifeste en
cas de surdosage (voir cette rubrique).
5.2 Propriétés pharmacocinétiques
La cinétique par voie orale se caractérise par une absorption rapide (Tmax = 1 à 2 heures).
Le temps de demi-vie sérique est de 2,3+/-1,3 heures (le temps de demi-vie peut être
augmenté chez le très jeune enfant).
Le degré de liaison aux protéines plasmatiques est inconnu.
La pentoxyvérine et ses métabolites, après biotransformation, sont excrétés dans les urines.
5.3 Données de sécurité préclinique
Les données non cliniques issues des études de pharmacologie de sécurité, toxicologie en
administration répétée, génotoxicité et toxicité pour la reproduction, n’ont pas révélé de
risque particulier pour l’homme. Aucune étude conventionnelle de carcinogénicité n’a été
réalisée.
6. DONNEES PHARMACEUTIQUES
6.1 Liste des excipients
Le sorbitol à 70 pour cent non cristallisable (E420), le glycérol à 85 pour cent, le
propylèneglycol, le citrate de sodium, l’acide citrique monohydraté, la saccharine sodique, le
parahydroxybenzoate de méthyle (E218), le parahydroxybenzoate de propyle (E216),
l’arôme poire, l’arôme gin et de l’eau purifiée.
6.2 Incompatibilités
Sans objet.
6.3 Durée de conservation
3 ans
4

6.4 Précautions particulières de conservation
A conserver à température ambiante (entre 15 et 25 °C).
6.5 Nature et contenu de l’emballage extérieur
Flacon de 200 ml avec bouchon de sécurité.
6.6 Précautions particulières d’élimination et manipulation
Pas d’exigences particulières.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
Pierre Fabre Médicament
45, Place Abel Gance
F – 92100 Boulogne
8. NUMERO D’AUTORISATION DE MISE SUR LE MARCHE
BE238393
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE
L’AUTORISATION
Date de première autorisation : 05/03/2001
Date de dernier renouvellement :
10. DATE DE MISE A JOUR DU TEXTE
Date de mise à jour du texte : 02/2016
Date d’approbation du RCP : 03/2016
5
1
/
5
100%