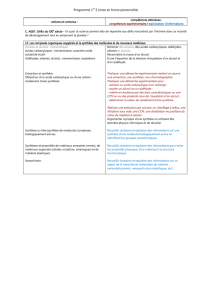
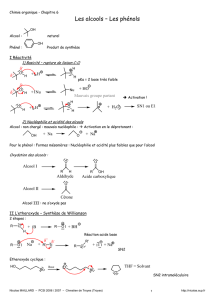
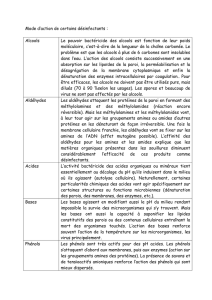
Les liaisons simples carbone-oxygène I) Les différentes familles de

Les liaisons simples carbone-oxygène
I) Les différentes familles de composés :
1. Alcool, éther-oxyde, phénol :
Les 3 familles :
Les phénols dérivent du phénol. Le fait que le groupement hydroxyle y soit lié à un carbone trivalent et non
tétravalent et la présence du cycle benzénique modifie leurs propriétés par rapport à celles des alcools.
Classe
2. Nomenclature des éther-oxydes :
Nomenclature systématique :
Ex :
Nomenclature usuelle des éther-oxydes symétriques ROR :
Ex :
Nomenclature des éther-oxydes cycliques : oxacyclane; attention, il faut remarquer que le nom "cyclane" se
rapporte au nombre de tous les atomes du cycle et pas seulement au nombre d'atomes de carbone.
Ex :
O
O
O O
O
3. Utilité des éthers-couronnes (Prix Nobel 1987 Lehn) :
Les éthers-couronnes sont des molécules cycliques qui ont la capacité de piéger efficacement les cations au sein
de leur cavité. La taille de la cavité permet de sélectionner le cation qui sera le mieux piégé.
En solvatant ainsi les cations, les éthers-couronnes permettent de dissoudre certains composés ioniques dans des
solvants organiques, et de laisser l’anion quasiment « nu » donc très réactif.
Ex :
O
O
O
OO
O
éther-18-couronne-6
;
KMnO
4
OOO
OO OOOO
OO O
K
solvant:
+ MnO
4-

II) Réactivité générale de la liaison C-O :
1. Acido-basicité :
Ampholyte : cas des alcools
Cas des phénols :
Comment justifier la différence pK
A
(ROH/RO
-
)
≈
16 / pK
A
(PhOH/PhO
-
)
≈
10 ?
2. Oxydo-réduction :
Def en chimie organique :
a. Couples redox :
Alcools non oxydables
Stades d’oxydation

b. Nature des oxydants :
Oxydants puissants : ils permettent de passer directement de l’alcool primaire à l’acide carboxylique
Oxydant doux : il permet d’arrêter l’oxydation au stade de l’aldéhyde. Il est toutefois préférable de distiller au
fur et à mesure l’aldéhyde pour être sûr de l’isoler et de l’empêcher de continuer à réagir.
3. Nucléophilie-électrophilie des alcools :
Site électrophile – site nucléophile :
Activitation de l’électrophilie du C
α
:
Activation de la nucléophilie de l’O :
III) Synthèse de Williamson :
1. Bilan et mécanisme :
Bilan :

Ex :
1)
2) La réaction est également possible avec les phénolates
Conditions expérimentales :
Mécanisme :
Compétition :
2. Obtention des ions alcoolates RO
-
:
Par une réaction acido-basique avec
Par une réaction redox avec
3. Synthèse de Williamson intramoléculaire :
Intérêt :
Comment favoriser la cyclisation intramoléculaire par rapport à une réaction intermoléculaire ?
IV) Obtention d’un dérivé halogéné à partir d’un alcool :
Objectif :
OI
DMSO
+
O+Br
H
2
O, HO
-

1. Par action d’un hydracide HX :
Principe :
Bilan :
Mécanisme :
Rendement :
2. Par utilisation d’un agent halogénant :
Bilan :
Bilan de l’halogénation Agent halogénant Remarques
Les mécanismes ne sont pas au programme.
 6
6
 7
7
1
/
7
100%