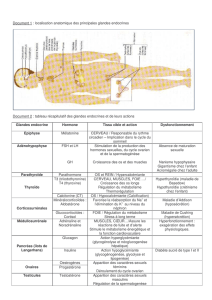
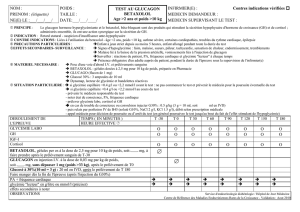
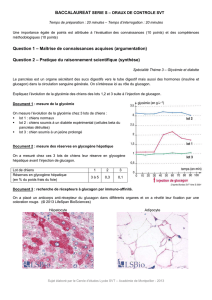
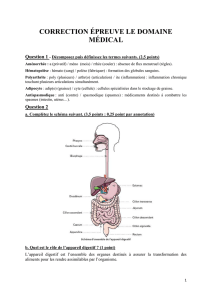
Effets du tubulaires rénaux glucagon chez l`homme - iPubli

S NOTE ORIGINALE
Bs ; : ro3
1
Effe ts
du tubulaires rénaux
glucagon chez
l'homme
L
·��-



RÉFÉRENCES
1
/
4
100%