Synthèse de l'aspirine : Protocole de laboratoire

Chimie organique Cahier de laboratoire 19
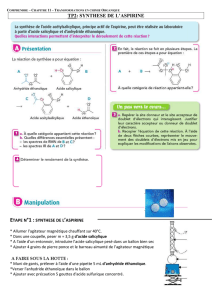
EXPÉRIENCE 5!: SYNTHÈSE DE L’ASPIRINE (ACIDE ACETYLSALICYLIQUE)
Travail individuel
Durée trois semaines
SIMDUT: ACIDE SALICYLIQUE, ANHYDRIDE ACÉTIQUE, ACIDE PHOSPHORIQUE,
ÉTHANOL
Théorie
L'acide salicylique (l'acide o-hydroxybenzoïque) est le plus important des acides
phénoliques. Il sert essentiellement à la préparation de l'aspirine. C’est en 1897 que le
chimiste allemand Hoffmann a réalisé pour la première fois la synthèse de l’aspirine.
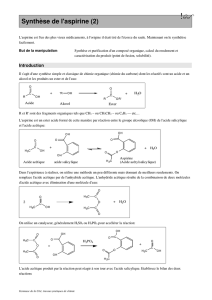
On représente ci-dessous les formules semi-développées des réactifs et des
produits intervenant dans cette synthèse.
http://sgbd.ac-poitiers.fr/bde/exos/98LGB046/98LGB046.htm
Références
Flamand, E. Bilodeau J. Chimie Organique, Expériences de laboratoire. Modulo-
Griffon, Mont-Royal, 106pp. 2003

Chimie organique Cahier de laboratoire 20
Procédure
Partie A:.
1. Placer 9,4 g d'acide salicylique dans une fiole conique de 125 ml
2. Ajouter 15 ml d'anhydride acétique et 10 gouttes d'acide phosphorique.
3. Chauffer la fiole dans un bain-marie avec une plaque chauffante, en maintenant la
température entre 60°C et 65°C pendant 30 minutes tout en agitant.
4. Placer un flacon laveur dans un bain de glace (1 bain de cuivre pour 2 personnel).
5. Lorsque le chauffage est terminé, placer la fiole conique sur la table et ajouter en
agitant avec une tige de verre, 30 ml d'eau glacée du flacon laveur.
6. Placer la fiole conique dans le bain de glace et agiter périodiquement avec une tige
de verre pendant 10 minutes ou jusqu'à ce que le produit soit solidifié en un bloc.
7. Peser un bécher de 250 ml identifié, avec un papier filtre.
8. Filtrer les cristaux sous vide avec le filtre pesé et laver les cristaux avec environ
20 ml d'eau froide du flacon laveur.
9. Transférer le papier-filtre et les cristaux dans le bécher de 250 ml identifier.
10. Placer le bécher sous la hotte pour la semaine.
Fin du laboratoire
Partie B:.
11- Peser le bécher de 250 ml et caractériser le produit obtenu par le point de fusion.
12. Ajouter précisément 15 ml d'éthanol 95% et 40 ml d'eau dans le bécher
contenant les cristaux (250 ml), enlever le filtre.
13. Chauffer le bécher de 250 ml sur la plaque chauffante jusqu'à dissolution
complète des cristaux.
14. Quand tout est dissous, placer le bécher de 250 ml sur la table pour qu'il puisse
refroidir lentement.
15. Lorsqu’il y a apparition de cristaux, compléter la cristallisation en plaçant le
bécher de 250 ml et un flacon laveur dans un bain de glace (1 bain pour 2
personne). La cristallisation est complète lorsque le produit est solidifié en un
bloc.
16. Peser un bécher de 150 ml identifié, avec un papier filtre.
17. Filtrer sous vide en utilisant le papier-filtre pesé, et en lavant les cristaux avec
une quantité minimale d'eau froide du flacon laveur.
18. Transférer les cristaux et le papier-filtre dans le bécher de 150 ml identifier
19. Placer le bécher dans la hotte pour la semaine.
Fin du laboratoire
Partie C
20. Peser le produit obtenu, calculer le rendement et caractériser l'aspirine
expérimentale et l'aspirine pure par le point de fusion et le spectre infra-rouge.

Chimie organique Cahier de laboratoire 21
Expérience 5 Synthèse de l’aspirine
Rédaction du rapport scientifique
Page de présentation
Introduction
• Présentation de l’expérience (sujet amené)
• Résumé de la théorie (1 page)
• Hypothèse
Méthodologie
• Référence
• Corrections, modifications ou ajouts apportées
Résultats et calcul
• Tableau des propriétés physico-chimiques
• Mécanisme de la réaction
• Équation de masse balancée (tableau des rapports molaires)
• Tableau des résultats (rendement, point de fusion, etc)
• Calcul du rendement
• Spectre expérimental (corrélation avec produit pur)
Exemple d’équation de masse balancée
Acide
salicylique
+
Anhydride
acétique
→
Aspirine
+
Acide acétique
Masse molaire
(g/mol)
108,16
Masse
(g)
9,41
Mole
Rapport molaire
(environ)
Discussion
• Parallèle avec la théorie
• Explications des résultats contradictoires
Conclusion
Médiagraphie
Annexe
• Spectre théorique
• Fiche signalétique de l’acide salicylique
1
/
3
100%