LA LIAISON CHIMIQUE

1) Définition :
I) Présentation des alcools :
Chapitre 6 : LES ALCOOLS ET LEURS DERIVES
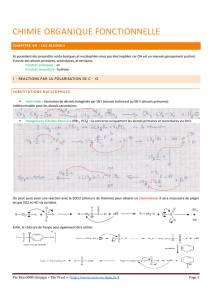
Dans un alcool, un groupe hydroxyle (─ OH) est relié à un
carbone (carbone fonctionnel), lui-même relié à 3
atomes de carbone ou d'hydrogène par trois liaisons
covalentes simples. La formule générale est donc :
S 5 F
R, R', R" sont, soit des chaînes commençant par un atome
de carbone C, soit des atomes d'hydrogène H.
R, R', R" sont appelés groupes résiduels.
La formule développée de l'alcool pourra être considérée comme provenant
du remplacement d'un atome d'hydrogène H par un groupe hydroxyle ─ OH.
Dans le cas d’un alcane CnH2n + 2 CnH2n + 1OH alcool saturé.
Le groupe hydroxyle ─ OH est relié à un groupe alkyle CnH2n + 1 linéaire
ou ramifié qu'on notera R : R ─ OH

2) Nomenclature :
I) Présentation des alcools :
Chapitre 6 : LES ALCOOLS ET LEURS DERIVES
On recherche la chaîne carbonée la plus longue, contenant le carbone
fonctionnel; la nomenclature s'établit à partir du nom de l'hydrocarbure dont
l'alcool dérive, en remplaçant le suffixe ane par anol en indiquant, si
nécessaire, le numéro du carbone fonctionnel.
S 5 F
Exemple : CH3 ─ OH méthanol ; CH3 ─ CH2 ─ OH éthanol ;
CH3 ─ CH2 ─ CH2 ─ OH propan-1-ol ;
CH3 ─ CHOH ─ CH3 propan-2-ol.
Exemple : 3-méthylbut-2-èn-1-ol
(le "e" de "ène" a disparu)
Exemple : but-2-yne-1,4-diol
Exemple : Molécule contenant un groupe aryle (groupe phénylique ou cycle
benzénique) : phénol 1,3-dihydroxybenzène

3) Les polyalcools :
I) Présentation des alcools :
Chapitre 6 : LES ALCOOLS ET LEURS DERIVES
Le groupe fonctionnel alcool peut être présent plusieurs fois dans la même
molécule :
S 5 F
-
L'éthan-1,2-diol ou glycol (HO ─ CH2 ─ CH2 ─ OH) est un dialcool utilisé lors
de la formation de polymères linéaires et comme fluide antigel.
-
Le propan-1,2,3-triol ou glycérol est un trialcool. Il est utilisé
pour la synthèse des corps gras (triesters du glycérol).
Inversement, il peut être extrait de corps gras par hydrolyse.
Le glycérol est aussi utilisé pour la formation de polymères tridimensionnels
comme les peintures glycérophtaliques.
-
Le glucose C6H12O6, sous forme cyclique est un polyalcool :

4) Les trois classes d’alcool :
I) Présentation des alcools :
Chapitre 6 : LES ALCOOLS ET LEURS DERIVES
Tous les alcools possèdent des propriétés communes dues à la présence du
groupe hydroxyle ─ OH :
S 5 F
ces propriétés définissent la fonction alcool.
Ces propriétés sont cependant légèrement modifiées par le fait que le
carbone fonctionnel est relié à 2, 1 ou aucun atome d'hydrogène.
Il existe trois classes d'alcools :
alcool primaire alcool secondaire alcool tertiaire

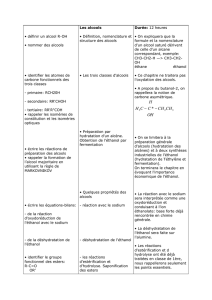
1) Production d’éthanol par fermentation alcoolique :
II) Production des alcools :
Chapitre 6 : LES ALCOOLS ET LEURS DERIVES
L'alcool éthylique ou éthanol se forme naturellement lors de la fermentation
des sucres des fruits (raisin, pomme, poire ...) ou de l'amidon des graines (riz,
orge, blé, seigle …).
S 5 F
En présence de levures, les sucres se transforment lentement en alcool
éthylique (éthanol) en produisant du gaz CO2.
C6H12O6 2 CH3 ─ CH2 ─ OH + 2 CO2
A partir du glucose, on peut écrire :
La fermentation nécessite l'action de catalyseurs biologiques, les
enzymes des levures.
Remarque :
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
1
/
19
100%