preparation de l`acide 2-acetoxybenzoique

1
EPREUVE FONDAMENTALE DE CHIMIE
Durée : 6 h Coef. : 7
Toutes les calculatrices de poche, y compris les calculatrices programmables et
alphanumériques, dont la surface de base ne dépasse pas 21 cm de long et 15 cm de large, sont
autorisées c~ condition que leur fonctionnement soit autonome et qu’il ne soit pas fait usage
d’imprimantes.
PREPARATION DE L’ACIDE
2- ACETOXYBENZOIQUE
(Acide acétylsalicylique ou aspirine)
L’acide 2-hydroxybenzoïque (acide salicylique) est un analgésique puissant. Toutefois son emploi direct est
contre-indiqué du fait d’une acidité élevée. La transformation en dérivé acétylé permet une meilleure tolérance
par l’organisme dans lequel l’agent actif est libéré lentement sous l’action des acides gastriques. Antipyrétique et
analgésique, l’aspirine est le médicament le plus utilisé dans le monde (20 000 tonnes par an).
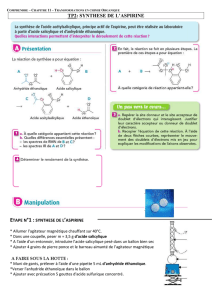
I - Principe
On prépare l’aspirine par réaction entre l’acide salicylique et l’anhydride acétique (ou anhydride éthanoïque) en
présence d’une petite quantité d’acide sulfurique concentré.
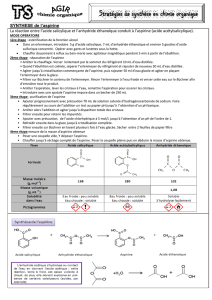
II - Données techniques
-Acide salicylique : solide blanc, peu soluble dans l’eau à froid, soluble à chaud, très soluble dans l’alcool
et l’éther F = 155-156°C.
-Anhydride acétique : liquide incolore, inflammable, corrosif par contact ; vapeurs très irritantes pour les
yeux et les voies respiratoires. F = -73°C ; Eb760 = 139,5°C ; d42° = 1,082.
Il s’hydrolyse en acide en présence d’humidité.
-Acide acétique pur : liquide incolore, inflammable ; provoque de graves brûlures par contact avec la
peau. F = 16,5°C ; Eb760 = 118°C ; d420 = 1,049.
-Acide sulfurique concentré : provoque de graves brûlures par contact avec la peau très corrosif ; réaction
très exothermique avec l’eau.
-Hydrogénocarbonate de sodium : solubilité dans l’eau : 100g.L-1 à 20°C.
-Ethanol : liquide incolore, inflammable. Eb760 = 78,4°C ; d420 = 0,795.
-Aspirine : solide blanc, peu soluble dans l’eau (3,3g.L-1 à 25°C), très soluble dans l’éthanol. Se
décompose facilement à la chaleur.
Y.LR -4N-91
SUJET N° 1

2
III - Mode opératoire
A -Préparation
Dans un réacteur bien sec équipé d’un agitateur et d’un réfrigérant, introduire successivement 15 g d’acide
salicylique sec et 22,5 cm3 d’anhydride acétique. Ajouter 5 gouttes d’acide sulfurique concentré. Agiter. Chauffer
le mélange à l’aide d’un bain marie maintenu entre 50 et 60°C pendant 25 minutes.
B - Séparation
Sans attendre le refroidissement verser immédiatement par le sommet du réfrigérant 15 cm3 d’eau en prenant
garde notamment aux vapeurs chaudes et acides. Quand l’ébullition est calmée, ajouter 50 cm3 d’eau froide et
agiter à température ambiante jusqu’à apparition des cristaux. Lorsque les premiers
cristaux apparaissent, rajouter 50 cm3 d’eau glacée et refroidir dans la glace jusqu’à cristallisation complète.
Ecraser le produit avec un agitateur. Filtrer sur büchner. Laver les cristaux avec un peu d’eau froide. Essorer
soigneusement, sécher. Peser
C - Purification
L’aspirine obtenue est impure et doit être recristallisée. Deux procédés sont proposés. Partager l’aspirine brute en
trois quantités approximativement égales par pesée. Noter les masses respectives m1, m2, m3.
1ère méthode : mouiller la première part de cristaux avec quelques cm3 d’éthanol. Chauffer doucement pour
dissoudre le solide dans une quantité suffisante d’éthanol à l’ébullition. Noter le volume de solvant utilisé.
Ajouter alors, trois fois plus d’eau chaude que d’éthanol.
S’il se forme un précipité, chauffer rapidement et ajouter éventuellement un peu de solvant approprié jusqu’à
dissolution complète. Laisser refroidir sans agiter. Les cristaux d’aspirine se forment. Refroidir et laisser reposer
30 minutes.
Filtrer sur büchner, laver à l’eau froide, essorer. Sécher le produit sur papier filtre à l’air ou sur verre de montre à
l’étuve à 80°C. Peser le produit sec. Prendre son point de fusion au banc de Kofler.
2ème méthode : à la seconde partie d’aspirine, ajouter avec précautions, par petites portions et en agitant, 70 cm3
de solution saturée d’hydrogénocarbonate de sodium. Agiter pour dissoudre. Filtrer sur büchner si nécessaire.
Transvaser et ajouter, en agitant, 35 cm3 d’acide chlorhydrique à 5 mol.L-1 .
Refroidir dans la glace jusqu’à recristallisation complète du produit. Filtrer sur büchner, laver à l’eau froide... (et
procéder à toutes les opérations finales de la méthode précédente).
3ème part : la 3ème part d’aspirine brute est séchée. Peser le produit sec et prendre son point de fusion.
IV - Compte rendu et questions
1 - Ecrire l’équation bilan de la réaction. De quel type de réaction s’agit-il ?
2 - Quel est le rôle de l’acide sulfurique concentré ?
3 - Pourquoi utilise-t-on l’anhydride acétique de préférence à l’acide acétique ?
4 - Que se passe-t-il lorsqu’on ajoute de l’eau au mélange réactionnel après avoir cessé de chauffer ?
5 -Identifiez les espèces chimiques contenues dans le filtrat à la fin des opérations de séparation.
6 - Dans le premier procédé de purification, quelles précautions prenez-vous ? Pourquoi le chauffage doit-il
être rapide ?

3
7 - Après dissolution lors de la seconde méthode de purification, identifier les espèces chimiques en solution
(après avoir écrit l’équation de la réaction). Pourquoi faut-il rajouter la solution d’hydrogénocarbonate par petites
portions ? Quel est le rôle de l’acide chlorhydrique ? Ecrire l’équation de la réaction.
8 - Calculer les nombres de moles des réactifs utilisés. Conclure. Quelle masse totale d’aspirine devrait-on
obtenir ?
9 - Donner le rendement en produit brut pour l’aspirine. Puis pour chaque fraction purifiée. Décrire chaque
produit et donner son point de fusion.
DOSAGE DE L’ASPIRINE OU ACIDE ACETYLSALICYLIOUE
Il existe deux possibilités pour doser l’aspirine.
-titrage pH métrique de l’acide acétylsalicylique par la soude.
-dosage en retour après saponification de l’acide acétylsalicylique.
I - Préparation et étalonnage des solutions
Remarque préliminaire : l’aspirine est peu soluble dans l’eau, donc avant d’étalonner la solution de soude, il faut
préparer la solution d’aspirine.
1) Préparation de la solution d’aspirine
- broyer, à l’aide d’un mortier, un cachet d’”aspirine 500” en poudre fine, transvaser dans une fiole de 500 mL
- agiter, à froid, à l’aide d’un agitateur magnétique pendant 1/2 heure. (Il se peut qu’il reste un peu d’excipient
non dissous)
2) Etalonnage de la solution de soude (c = 0,5 mol.L-1 )
-étalonnage effectué par pesée d’hydrogénophtalate de potassium RP.(204,23 g.mol-1)
- dosage visuel.
-faire deux essais concordants.
-calculer la concentration de la solution de soude.
3) Préparation de la solution diluée de soude
-effectuer une dilution au 1/10 de la solution précédente.
II - Dosages de l’aspirine
1) Titrage pH métrique de l’aspirine
-titrage effectué avec la solution diluée de soude.
-PE : 100 mL de la solution d’aspirine préparée en I - 1).
(Le volume pourra être mesuré à l’aide d’une pipette jaugée ou d’une fiole jaugée)
-effectuer le titrage pH métrique (électrodes : verre + ECS)
-déterminer la concentration molaire et massique de la solution d’aspirine, en déduire la masse d’aspirine
contenue dans un cachet.

4
2) Dosage en retour de l’aspirine après saponification
a - Saponification de l’aspirine
Remarque : prévoir deux essais.
-mettre dans un erlenmeyer : - 1 comprimé d’aspirine 500.
- 20 mL de solution de soude à environ 0,5 mol.L-1
-porter lentement à ébullition, en agitant (on pourra utiliser un agitateur magnétique chauffant) et
maintenir une ébullition douce pendant 2 minutes.
-laisser refroidir.
b - Dosage en retour
Le titre de la solution d’acide chlorhydrique sera donné par le centre d’examen.
-dosage visuel
- indicateur : phénolphtaleine.
- mettre dans la burette la solution d’acide chlorhydrique de titre connu.
-calculer la masse d’aspirine contenue dans un cachet.
-comparer les résultats obtenus par les deux méthodes.
QUESTIONS
I - Etalonnage de la solution de soude
-Indiquer l’équation de la réaction d’étalonnage et l’expression littérale de la concentration.
-Indiquer le ou les indicateurs colorés à utiliser.
II - Dosages de l’aspirine
1) Titrage pH métrique
-Indiquer l’équation de la réaction de titrage et l’expression littérale de la concentration de la solution
d’aspirine.
-Justifier le choix d’un indicateur coloré pour un dosage visuel.
-Déterminer le pKA du couple acide salicylique/salicylate.
2) Saponification
-Indiquer l’équation de la réaction de saponification de l’acide acétylsalicylique par la soude.
-Donner l’expression littérale de la masse d’aspirine contenue dans un cachet.
-Justifier l’appellation “aspirine 500”.
1
/
4
100%