La Méiose

Gamétogenèse
I) Introduction
A. Types de cellules
Être humain est composé de plusieurs milliers de milliards de cellules. Il possède 2 types de cellules :
cellules somatiques et cellules germinales.
La majorité des cellules sont des cellules somatiques qui forment : les tissus, les organes et les appareils.
La minorité des cellules de l’organisme sont des cellules germinales.
B. Généralités sur la gamétogenèse
La gamétogenèse se déroule dans gonades (testicules chez l’homme ou ovaires chez la femme). Elle est
assimilée à une activité exocrine. L’activité endocrine des gonades correspond à la synthèse des
hormones stéroïdes. La gamétogenèse ne concerne que les cellules germinales, elle est l’ensemble des
mécanismes aboutissant à la formation des gamètes (= cellules hautement spécialisées intervenant dans
la reproduct° séxuée des individus).
Le gamètes mâle est l’une des plus petites cellules de l’organisme et est une cellule mobile. Le gamète
femelle qui est l’une des plus grosses cellules de l’organisme, se charge des réserves. La gamétogenèse
masculine est la spermatogenèse (=format° des spz). La gamétogenèse féminine est l’ovogenèse
(=product° d’ovocytes). Au cours de la gamétogenèse survient en suivant la méiose.
II) La Méiose
La méiose ne concerne que les cellules germinales. Elle permet également de réduire de moitié le
nombre de chromosome. Les chromosomes diploïdes deviennent haploïdes au cours de la méiose c à d,
qu’ils passent de : 2n où n=23 chr -> n où n=23 (= 23 chr = n cellules haploïdes).
La méiose assure simultanément deux fonctions : elle permet de réduire le nbre de chromosomes
(=permet la mise en place de cellules haploïdes) et elle assure le brassage de l’IG. En effet les gamètes se
distinguent des autres cellules de l’organisme par leur haploïdie et leur diversité génétique. La
recombinaison génétique et la ségrégation au hasard des chromosomes font des gamètes des cellules
uniques par leur PG. Le rythme et le calendrier de la méiose diffère selon le sexe. La méiose est un
mécanisme de division cellulaire particulier à la lignée germinale et elle est définie comme la succession
de deux divisions cellulaire qui suivent une phase unique de réplication de l’ADN.

1. Etapes de la Méiose
A. La réduction de nombre de chromosomes : première division de méiose.
Elle se produit lors de la méiose I. En effet la méiose est composée de deux divisions cellulaires
successives : méiose I et méiose II, précédées d’une phase de synthèse de l’ADN.
Au cours de cette phase de synthèse : les 46 chromosomes de la cellule qui entre en méiose, doublent leur
qté d’ADN et se retrouvent à deux chromatides sœurs, elles sont à 2n, n étant le nbre haploïde de
chromosomes (23) et leur contenu d’ADN se retrouve à 4c (c, étant la qté d’ADN d’une cellule haploïde).
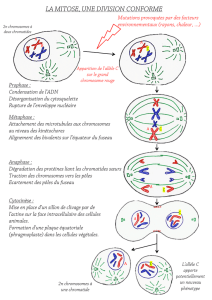
La méiose I, est réductionnelle et très longue à cause de la durée de la prophase qui est elle-même divisée
en 5 stades : LEPTOTENE, ZYGOTENE, PACHYTENE, DIPLOTENE, DIACINESE. Ces stades correspondent à des
modifications morphologiques des chromosomes.
Au cours du stade leptotène : Chromosomes se condensent, s’individualisent sous la forme de longs
filaments, chaque filament correspond à un chromosome constitué de deux chromatides sœurs.
Stade zygotène : commence dès la mise en place des appariements entre les chromosomes homologues.
Ces appariements sont appelés SYNAPSIS.
Au cours de ce stade le noyau se polarise. Les extrémités des
chromosomes glissent sur l’enveloppe nucléaire et se réunissent à un pôle du noyau. La reconnaissance
initiale entre les chromosomes initiales se fait au niveau des extrémités homologues qui se rapprochent
sur l’enveloppe nucléaire et s’apparient. Ensuite, l’appariement s’étend progressivement à toute la
longueur des chromosomes. L’appariement des chromosomes homologues est réalisé par une structure
protéique que l’on appelle : COMPLEXE SYNAPTONEMAL. La ME (microscopie électronique), montre que
ce complexe synaptonémal est une structure en forme en de rails formée de deux rails de deux éléments
latéraux et d’un élément central plus fin. De fins filaments transversaux relient ces trois éléments. La
chromatine des chromosomes homologues apparaît sous la forme de boucles attachées aux éléments
latéraux. Sur l’élément central, des condensations sont présentes, il s’agit de nodules de recombinaison.
Ces nodules correspondent à des complexes protéiques multi-enzmatique.
Au cours du stade pachytène : complexes synaptonémaux s’étendent sur toute la longueur des
chromosomes. A ce stade chaque paire de chromosomes homologues est appelé bivalents ou tétrade.
C’est à ce stade que débutent les échanges de matériel génétique entre les chromatides. Les échanges de
matériel sont appelés recombinaisons génétiques ou crossing-over.
Au stade diplotène : les protéines du complexe synaptonémal commencent à se dissocier ce qui a pour
conséquence que les chromosomes homologues de chaque bivalent se séparent mais reste en contact en

un ou plusieurs points appelés chiasmas. Chiasmas = correspondent aux zones où ont lieu les
recombinaisons génétiques entres les chromatides.
A la diacinèse : la condensation des chromosomes est presque maximale -> permet l’identification des
chromatides, des centromères et des chiasmas restants. La diacinèse marque la fin de la prophase de
première division de méiose.
La méiose I, se poursuit par la Métaphase I. Au cours de ce stade, les bivalents se déposent sur le fuseau
au niveau de la plaque équatoriale. Les chromosomes sont alors au maximum de leur condensation, les
chiasmas sont parfaitement visibles.
Lors de l’anaphase I, il n’y a pas de clivage des centromères, les chiasmas disparaissent et ce sont les
chromosomes qui ségrégent au hasard vers les pôles du fuseau.
En télophase I, chaque cellule fille possède un lot haploïde de chromosomes recombinés et dupliqués, les
chromatides sœurs sont liées au niveau du centromère.
La première division de méiose est terminée.
B. La seconde division de méiose
Cette seconde division est dite équationnelle. Elle suit rapidement la première division de méiose, les
chromosomes restent condensés et se disposent rapidement sur le second fuseau méiotique. Dans
l’espèce humaine les chromosomes passent directement de la télophase I à la métaphase II. Au cours de
l’anaphase II : les centromères se clivent, les chromatides sœurs libérées se répartissent au hasard.
En télophase II : chaque cellule fille hérite d’un lot haploïde de chromosomes formés d’une seule
chromatide.
2. Bilan de la méiose
La recombinaison génétique et ségrégation au hasard des chromosomes assure la diversité des individus.
La ségrégation au hasard des chromosomes maternels et paternels dans les cellules filles, assure le
brassage de l’IG. Le noyau de la cellule qui entre en méiose contient 2 paires de chromosomes
homologues. Le nombre de combinaisons chromosomiques pouvant être obtenu par la répartition au
hasard des chromosomes à partir de cette cellule est de 223. C-à-d plusieurs millions. Ce nombre est
considérablement amplifié par les phénomènes de crossing-over. Les crossing-over impliquent la cassure
des doubles hélices d’ADN en des points parfaitement homologues puis il y aura la réunion en des points
parfaitement homologues. Puis il faudra qu’il y ait réunion réciproque. Par ce mécanisme de crossing-over
la méiose opère une redistribution des gènes entre les chromosomes homologues.

Il existe des variations dans le déroulement de la méiose en fonction du sexe de l’individu. La
spermatogenèse donne naissance à 2 populations de spermatozoides (23X et 23y), alors que l’ovogenèse
n’est à l’origine que d’une seule population d’ovocytes (23X). La psermatogenèse donne naissance à 4
spermatozoides de même taille. Cette différence de taille s’explique par le fait que l’ovocyte hérite de la
quasi-totalité du cytoplasme de la cellule de départ.

La Spermatogenèse
I) Organisation et fonction de l’appareil génital masculin
Elle (spermatogenèse) regroupe l’ensemble des phénomènes qui se déroule au cours de l’évolution de la
lignée germinale mâle et qui à partir des spermatogonies aboutit à la formation des spz. Elle débute dès
la puberté et elle suit un rythme continu jusqu’à un âge avancé. La spermatogenèse se déroule dans les
testicules au niveau des TS.
L’appareil génital masculin exerce deux fonctions complémentaires :
Une fonction exocrine : production de spz, émis hors de l’organisme dans un liquide de composition
complexe. Liquide complexe appelé : liquide séminal.
Une fonction endocrine : production d’hormone sexuelle, essentiellement de la testostérone.
1. Structure du testicule.
Le testicule : organe ovoïde entouré d’une albuginée, qui est une capsule conjonctive fibreuse peu
extensible qui contient des cellules musculaires lisses et qui est épaisse à son pôle supérieur. Partant de
cet épaississement et irradiant vers la périphérie, de fines cloisons conjonctives délimitent des lobules
testiculaires. Ces lobules sont au nombre de 200 à 300 par testicule. Chaque lobule contient 2 à 3 TS.
2. Structure de l’épididyme
Les TS de chaque lobule confluent vers un tube droit. Ces tubes droits se jettent dans un réseau appelé
RETE TESTIS. Ce réseau communique avec les voies de sortie du testicule représentées par l’épididyme.
L’épididyme est une formation qui coiffe le testicule et qui est présent à partir du pôle supérieur. Il est
composé de trois parties : la tête, le corps, la queue.
Dans la tête de l’épididyme : se trouve les cônes efférents.
Le canal épididymaire : dans lequel confluent les cônes efférents, occupe le corps et la queue de
l’épididyme. Il se prolonge hors de l’épididyme par le canal efférent.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
1
/
16
100%