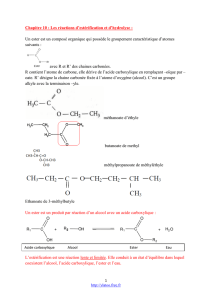
Estérification et Hydrolyse : Chapitre de Chimie Organique

Lycée J-B Schwilgué - SELESTAT
GROSSHENY L.
Chapitre 11
La réaction d’estérification et d’hydrolyse :
un équilibre chimique.
I. Etude quantitative de la réaction d’estérification.
1. Comment étudier expérimentalement la réaction d’estérification ?
- Calculer le rendement d'une transformation.
Il faut déterminer le % d’acide restant après réaction. On réalise le dosage de l’acide restant par la soude
(v
oir TP)
Le rendement de la réaction d’estérification est : ρ =
)max( )( estern esternf
=
)( )( autréactifdéfn esternf
2. Caractérisation de la réaction d’estérification.
Les réactions d’estérification et d’hydrolyse sont inverse l’une de l’autre. ; elles ont lieu
simultanément :
Dans ce cas, l’eau n’est pas le solvant mais le produit de la réaction.
Qr =
]].[[ ]].[[ acidealcool eauester
=
)().( )().( acidenalcooln eaunestern
En TP, on a vu :
Acide carboxylique
alcool Ester Eau
Estérification 1
0.33 1
0.33
0.67
0.67
La réaction d’estérification n’est pas totale ; elle est limitée.
Pour un alcool primaire, l'estérification a un rendement de 67 % .
Pour un alcool secondaire, l'estérification a un rendement de 60 % .
Pour un alcool tertiaire, l'estérification a un rendement de 5 % .
3. Comment contrôler le rendement de la réaction ?
-Savoir que l'excès de l'un des réactifs et/ou l'élimination de l'un des produits déplace l'état d'équilibre du
système dans le sens direct
Pour augmenter le rendement, il faut former une plus grande quantité d’ester.
D’après le critère d’évolution spontanée et la valeur de Qr =
]].[[ ]].[[ acidealcool eauester
=
)().( )().( acidenalcooln eaunestern
, le
rendement augmente si la réaction à lieu dans le sens direct (formation d’eau ou d’ester)..
Pour que cela ait lieu, il faut :
• Eliminer un des produits : l’eau ou l’ester
on peut éliminer l’ester par distillation car la température des esters est faible
on peut éliminer l’eau par ajout d’un desséchant
Estérification
Hydrolyse

Lycée J-B Schwilgué - SELESTAT
GROSSHENY L.
• Ajouter l’un des réactifs :
Si les mélanges initiaux ne sont pas stœchiométriques, le rendement par rapport au réactif
limitant sera d’autant plus important que l’autre réactif sera en plus fort excès.
4. Comment contrôler la vitesse de la réaction ?
-Savoir qu'un catalyseur est une espèce qui augmente la vitesse d'une réaction chimique sans figurer dans
l'équation de la réaction et sans modifier l'état d'équilibre du système.
La réaction d'estérification est très lente.
Pour accélérer la réaction, on élève la
température
Pour accélérer la réaction, on ajoute un
catalyseur ( ion H
+
).
C’est quoi un catalyseur ?
Un catalyseur ne modifie pas un état d’équilibre (il catalyse la réaction dans les deux sens de la même
façon), il permet d’atteindre plus rapidement l’état d’équilibre.
Un catalyseur est une espèce qui augmente la vitesse d'une réaction chimique sans figurer dans l'équation de
la réaction.
II. Etude de la réaction d’hydrolyse.
-Savoir que les réactions d'estérification et d'hydrolyse sont inverses l'une de l'autre et que les
transformations associées à ces réactions sont lentes.
-Écrire l'équation des réactions d’hydrolyses.
Les réactions d'estérification et d’hydrolyse sont inverses l’une de l’autre. Ce sont des réactions
lentes et limitées.
Pour un alcool primaire (l'estérification a un rendement de 67 %), donc l'hydrolyse un
rendement de 33 %.
Pour un alcool secondaire (l'estérification a un rendement de 60 %), donc l'hydrolyse un
rendement de 40 %.
Pour un alcool tertiaire (l'estérification a un rendement de 5 %), donc l'hydrolyse un
rendement de 95 %.
1
/
2
100%