DocCours Chimie Organique partie I

DocCours Chimie Organique partie I 1/9
Figure 1 : Nomenclature - introduction
Il n'y a qu'une centaine d'atomes dans le tableau, mais le nombre de molécules est quasi infini.
Par exemple, rien que pour les alcanes à 20 carbones (C20H42), il y a 366 319 isomères.
Les innombrables protéines et ADN de la chimie de la vie ont des milliers d'atomes de carbone : leur nombre
d'isomères est impensable. Il est impossible et inutile de nommer toutes ces molécules complexes.
Toutefois les règles de l'IUPAC (International Union of Pure and Applied Chemistry) a établi des règles précises
et complexes de nomenclature, qui ne s'appliquent que pour des molécules relativement simples.
L’utilitaire IUPAC (sur le site) permet de s’exercer (il n’est pas toujours d'accord avec les règles de ce document)
Le nom des molécules se met sous la forme suivante :
<substituants (préfixes)><chaine principale><fonction principale (suffixe)>
Exemple: 2,3-diméthylbutanal
Il n’y a pas d’espace dans le nom (sauf pour les acides carboxyliques et les esters)
Figure 2 : Nomenclature -Recherche de la fonction principale
Les fonctions suivantes sont classées par ordre de priorité décroissante.
Notes : Le
n'est pas un électron célibataire mais désigne le reste de la molécule à laquelle la fonction est liée,
et R désigne un groupe quelconque moins un H (exemple : méthyl (CH3) ; éthyl (C2H5) etc…)
Nom de la
fonction
Suffixe (si la fonction
est principale)
Préfixe (si fonction
secondaire)
Exemples
O
O H
Acide
carboxylique
Acide oïque
carboxy (C du
CO2H non inclus
dans la chaîne prinpale
OH
OOH
O
acide pentanedioïque
OH
OOH
O
OOH
acide
3-(carboxyméthyl)pentanedioïque
O
OR
Ester
oate d'alkyle
O
Oéthanoate de propyle
C N
Nitrile
nitrile (C du CN
inclus dans le nom)
cyano (C du CN non
inclus dans la chaîne
principale)
N12
2-méthylpropanenitrile
N
OOH acide
2-cyanopropanoïque
1
2
O
H
Aldéhyde
al (C du COH inclus
dans le nom)
oxo
O
propanal OH O
Oacide
oxoéthanoïque
O
R
Cétone
one (C du COR inclus
dans le nom)
oxo
O
pentan-2-one
O
O
4-oxopentanal
OH
Alcool
ol
hydroxy
O
OH
2-hydroxypropanal
OH
propan-2-ol
NH2
Amine
amine (voir détail plus
loin)
amino
NH2OH
NH2
propan-2-amine 2-aminopropan-1-ol
R
alcène>alcyne
(voir détail plus loin)
ène,yne,ane (voir
détail plus loin)
X
Halogénure
halogéno
Cl 2-chlorobutane
OR
Etheroxyde
alkoxy
O2-méthoxypropane
NO2
Nitroalcane
nitro
NO22-nitropropane
Autres exemples de composés polyfonctionnels (remarquer l'ordre de priorité des fonctions) :
OO
O
3-oxopropanoate de méthyle
O
hex-4-én-3-one
en fait
(4E)-hex-4-én-3-one
OH
NH2
3-aminobutan-1-ol
OH
O
2-hydroxy-5-méthylhexan-3-one
O
NH
1-méthoxy-N-méthylpropan-2-amine
O

DocCours Chimie Organique partie I 2/9
Figure 4 : Nomenclature –Recherche de la chaîne principale
On suppose que la fonction principale est connue (voir figure 2)
La chaîne principale se détermine grâce aux règles suivantes, rangées par ordre de priorité :
1) La chaîne principale doit contenir la fonction principale.
2) S’il y a plusieurs fois la fonction principale, (par exemple : diol , triol…),
la chaîne principale en contient le nombre maximum.
3) La chaîne principale doit être la plus longue possible.
4) Elle doit contenir le nombre maximal de substituants (ceux cités comme préfixes).
5) En cas d’égalité, elle doit contenir celui qui porte le plus petit numéro dans la numérotation de la chaîne.
6) S’il y a toujours égalité, elle doit contenir le premier substituant dans l’ordre alphabétique.
Voici quelques exemples où l’on indique entre parenthèses le critère qui a permis de trancher.
Numérotation de la chaîne principale
(les règles suivantes sont classées par ordre de priorité)
1) La fonction principale doit avoir le plus petit numéro possible.
2) S’il y a plusieurs fonctions principales dans la chaîne principale, il
faut attribuer le plus petit numéro possible à l’une d’entre elles.
3) Le numéro le plus petit possible doit être attribué à une liaison multiple
(peu importe si elle est double ou triple).
4) Le numéro le plus petit possible doit être attribué à un substituant.
5) En cas d’égalité, le plus petit numéro est attribué au premier substituant
dans l’ordre alphabétique
Figure 5 : Nomenclature –Nom spécifique des substituants courants
Certains groupements sont très courants et ont des noms spécifiques.
Isopropyl = méthyléthyl Tertiobutyle = diméthyléthyle Phényl = groupe C6H5 noté
Figure 3 : Nomenclature –Cas des hydrocarbures et amines
Hydrocarbures (composés de C et H uniquement)
C-C : alcane (si substituant : alkyl)
C=C : alcène (si substituant : alcényl)
C≡C : alcyne (si substituant : alcynyl)
Le suffixe ène devient én
s’il est suivi d’un autre suffixe
Amines
On note R1la chaine principale (définie dans le paragraphe suivant) nomenclature groupement
Amine secondaire : R1-NHR2on dit …(N-alkylamine) où alkyl = R2
Amine tertiaire : R1-NR2R3on dit …(N-alkyl-N-alkyl’amine) où alkyl = R2 et alkyl’ = R3
1
2
3
4
5
6
7
8
9
10
méthane
éthane
propane
butane
pentane
hexane
heptane
octane
nonane
décane
hexa-1,4-diène
plus précisément
(4E)-hexa-1,4-diène 3,4-diméthylcyclopentène3-méthylhept-1-én-5-yne
1234
5
2-éthylpentyle
Br OH
3-(bromométhyl)pentane (1) 2-éthylbutan-1-ol (1)
O
O
3-propylpentane-2,4-dione (2)
O
OH
3-(1-hydroxyéthyl)hexan-2-one (3)
Br
Cl
Br
Cl
3-(1-bromoéthyl)-1-chloro-3-éthylhexane (5) 2-bromo-3-(1-chloroéthyl)-3-éthylhexane (6)
Cl
1-chloro-3,3-diéthylhexane (4)
Cl
2-chloropenta-1,4-diène (4)
ClBr
2-bromo-4-chloropenta-1,4-diène (5)
OH
OH
OH
(3E)-pent-3-én-1-ol (1) pentane-1,4-diol (2)
pent-1-én-3-yne (3)
3-(1-méthyléthyl)hexan-2-one
ou 3-(méthyléthyl)hexan-2-one
ou 3-isopropylhexan-2-one
O
O
H
3-(1,1-diméthyléthyl)heptan-2-ol
ou 3-(diméthyléthyl)heptan-2-ol
ou 3-tertiobutylheptan-2-ol
ou 3-tert-butylheptan-2-ol
2-phénylpentane

DocCours Chimie Organique partie I 3/9
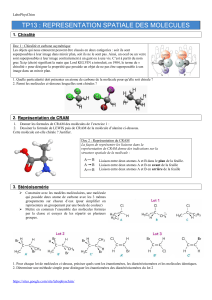
Figure 6 : Stéréochimie
Deux stéréoisomères ont la même formule développée plane, mais diffèrent par l’arrangement
tridimensionnel des atomes.
Stéréoisomérie de conformation (conformérie) même molécule
Libre rotation des liaisons simples C-C les molécules peuvent être disposés d'une infinité de façons dans
l'espace, chaque disposition possible correspond à un conformère de la molécule.
Deux conformères représentent la même molécule, dans des dispositions spatiales et état d’énergie différents.
On peut passer d’un conformère à l’autre sans rupture de liaison même molécule
Stéréoisomérie de configuration (ou plus simplement stéréoisomérie) molécules différentes
Si les stéréoisomères sont des molécules différentes, stéréoisomérie de configuration.
Ces molécules sont souvent appelées des stéréoisomères (sous-entendu de configuration).
Pour passer d’un stéréoisomère à un autre il faut nécessairement casser des liaisons molécules différentes
Figure 7 : Conformérie
Cas de l'éthane C2H6
Cas du butane C4H10
(Me = groupe méthyle)
Nom des conformations les plus caractéristiques du butane
Me
Me
23
3
2

DocCours Chimie Organique partie I 4/9
hexa-1,4-diène
plus précisément
(4E)-hexa-1,4-diène 3,4-diméthylcyclopentène3-méthylhept-1-én-5-yne
1234
5
2-éthylpentyle
Figure 8 : Conformérie
Cas du cyclohexane C6H12
Le cyclohexane présente de nombreuses
conformations dont les plus
remarquables sont :
La forme chaise : plus stable
* toutes liaisons décalées
* 6 H axiaux alternés
* 6 H équatoriaux alternés
La forme bateau : moins stable
* présence de liaisons éclipsées
* 6 H axiaux et 6 H équatoriaux non alternés
Cyclohexane monosubstitué
Considérons les deux formes chaises du méthylcyclohexane
On remarquera déjà que si dans une des chaises, le méthyl est
équatorial vers le haut, dans l'autre il sera axial vers le haut
Dans le cas du méthylcyclohexane, plus généralement des cyclohexanes monosubstitués par un groupe G (à la
place d'un H), les deux chaises n'ont pas la même énergie.
En effet, lorsque G est axial, il est très proche des 2 H axiaux du même côté que G.
Il y a des répulsions 1,3 diaxiales, déstabilisant la conformation.
Le tableau des préférences équatoriales indique les proportions moyennes de conformère équatorial qu’on
rencontre pour le cyclohexane monosubstitué en fonction de la nature de G(% à T=298 K ).
On constate que plus le substituant G est encombrant (plus volumineux), plus le conformère équatorial est
favorisé.
On note aussi la faible préférence équatoriale pour les halogènes dont la liaison C-X est longue et donne des
interactions 1,3 diaxiales moins fortes.
H H
H
H
H
H
H
HH
H
H
H
conformations chaises
du méthylcyclohexane
interactions 1,3 diaxiales
(répulsives)
La conformation chaise la plus stable d'un cyclohexane
monosubstitué par un groupe G est celle où G est équatorial
1
2

DocCours Chimie Organique partie I 5/9
Figure 9 : Stéréochimie (de configuration)
Rappel : Deux stéréoisomères (de configuration) ont la même formule développée plane, mais diffèrent par
l’arrangement tridimensionnel des atomes. Pour passer d’un stéréoisomère (de configuration) à un autre il faut
nécessairement casser des liaisons deux stéréoisomères sont des molécules différentes.
Il y a deux types de stéréoisomérie de configuration : l'énantiomérie et la diastéréoisomérie
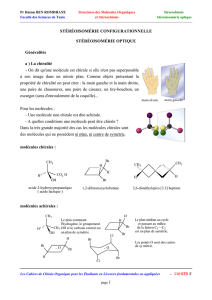
Figure 10 : Stéréochimie - Enantiomérie
Chiralité-énantiomères
Une molécule A est chirale si elle est différente de son image B dans un miroir.
Si c'est le cas, A et B sont deux énantiomères (cas de la figure)
Si A = B, A est achirale (A est égale a son image dans un miroir).
Une molécule est chirale Elle n'a aucun axe inverse de symétrie Sn(n=1,2,…)
Axe inverse de symétrie Sn= rotation de 2/n autour d’un axe suivie symétrie par rapport au plan
perpendiculaire à .
Cas importants (les seuls à retenir cette année): S1 = plan de symétrie ; S2 = centre de symétrie
On retiendra donc :
Une molécule possédant un plan ou un centre de symétrie est achirale (cas de la figure)
Activité optique-pouvoir rotatoire
Deux énantiomères ont mêmes propriétés chimiques et physiques, sauf une : le pouvoir rotatoire.
Seules les molécules chirales ont un pouvoir rotatoire, ou encore activité optique
Le pouvoir rotatoire est l'angle dont tourne le plan d'une lumière monochromatique polarisée et se mesure avec
le polarimètre de Laurent.
Loi de Biot :
i
[ ] i
i
l c
[]i est appelé pouvoir rotatoire spécifique de la molécule n°i
Molécule chirale : []≠ 0 ; achirale : [] = 0
Deux énantiomères A et B ont leur [] opposé : []A = -[]B
Conséquence : Mélange racémique = mélange en même quantité de 2 énantiomères; pas d'activité optique ; = 0
Figure 11 : Stéréochimie – Carbone asymétrique
Un carbone est dit asymétrique lorsqu’il est lié à 4 atomes ou groupes d’atomes différents
La molécule suivante possède un carbone asymétrique indiqué par une étoile.
Toute molécule possédant un seul carbone asymétrique est chirale
Attention - Erreurs classiques
Un carbone d’une double liaison ne peut jamais être asymétrique
(il n’est relié qu’à 3 groupes au lieu de 4)
Une molécule possédant plusieurs C* peut ne pas être chirale
La molécule suivante est achirale, pourtant elle a deux C*
Une molécule peut être chirale sans posséder de C*
La molécule suivante est chirale, pourtant elle n’a pas de C* (chiralité axiale)
*
*
*
plan ou centre de
symétrie dans la
molécule A
A est achirale (non chirale)
A est égale à son image dans
un miroir
A n'a pas d'activité optique
A ne fait pas tourner le plan de
polarisation de la lumière
A n'a pas de pouvoir rotatoire
 6
6
 7
7
 8
8
 9
9
1
/
9
100%