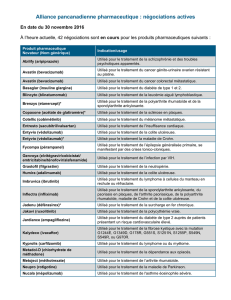
Guide de prise en charge des réactions indésirables à médiation

Guide de prise en charge des réactions indésirables
à médiation immunitaire
Indication
Mélanome non résécable ou métastatique
OPDIVO (nivolumab) est indiqué dans le traitement du mélanome non résécable ou métastatique à gène
BRAF
V600 de type sauvage chez les adultes
qui n’ont reçu aucun traitement antérieur.
Cancer du poumon non à petites cellules (CPNPC) métastatique
OPDIVO (nivolumab) est indiqué dans le traitement du cancer du poumon non à petites cellules (CPNPC) localement avancé ou métastatique chez les adultes
dont la maladie a progressé pendant ou après une chimiothérapie à base de platine. Les patients porteurs d’aberrations génomiques tumorales touchant EGFR
ou ALK doivent avoir présenté une progression de leur maladie pendant traitement dirigé contre ces aberrations avant de recevoir OPDIVO.
Renseignements importants sur l’innocuité
Ce guide a pour but de fournir des renseignements sur la prise en charge d’importants risques associés au traitement par OPDIVO pour le mélanome et
le CPNPC, y compris les endocrinopathies à médiation immunitaire, les e ets indésirables gastro-intestinaux, hépatiques, pulmonaires, rénaux, cutanés
(rash), neurologiques et autres e ets indésirables ainsi que les réactions à la perfusion.
Tous les patients traités par OPDIVO doivent recevoir une carte de renseignements en cas d’urgence pour les renseigner sur les symptômes des réactions
indésirables à médiation immunitaire et sur l’importance de les signaler immédiatement à leur médecin traitant. Les médecins traitants doivent également
conseiller aux patients de conserver cette carte sur eux en tout temps et de la montrer à tout professionnel de la santé qui leur prodiguera des soins.
Pour de plus amples renseignements, veuillez consulter la monographie d’OPDIVO, accessible sur le site Web de Bristol-Myers Squibb Canada à l’adresse :
http://www.bmscanada.ca.


Explorez les sections suivantes pour en apprendre davantage sur la prise
en charge des réactions indésirables à médiation immunitaire :
Qu’est-ce qu’OPDIVO ? 5
Détection et prise en charge des e ets indésirables associés au traitement 7
Endocrinopathies à médiation immunitaire 8
E ets indésirables gastro-intestinaux à médiation immunitaire 10
E ets indésirables hépatiques à médiation immunitaire 12
E ets indésirables pulmonaires à médiation immunitaire 14
E ets indésirables rénaux 16
E ets indésirables de la peau à médiation immunitaire 18
E ets indésirables neurologiques à médiation immunitaire 21
Autres réactions indésirables à médiation immunitaire 23
Réactions à la perfusion 25
Modifi cations du traitement en réponse aux réactions indésirables à médiation immunitaire 26


5
Qu’est-ce qu’OPDIVO ?
OPDIVO (nivolumab) est un médicament qui aide le système immunitaire à attaquer et à détruire les cellules cancéreuses.
La liaison des ligands PD-L1 et PD-L2 au récepteur PD-1 se trouvant à la surface des lymphocytes T inhibe la prolifération des lymphocytes T
et la production de cytokines. Une régulation positive des ligands du récepteur PD-1 survient en présence de certaines tumeurs, et cette voie
de signalisation peut contribuer à l’inhibition de la surveillance immunitaire active des tumeurs par les lymphocytes T. Le nivolumab est un anticorps
monoclonal humain de la famille des immunoglobulines G4 (IgG4) qui se lie au récepteur PD-1 et bloque son interaction avec les ligands PD-L1
et PD-L2, contrecarrant ainsi l’inhibition de la réponse immunitaire, y compris de la réponse antitumorale. Dans les modèles tumoraux chez
des souris syngéniques, le blocage de l’activité du récepteur PD-1 a entraîné une réduction de la croissance des tumeurs.
E ets indésirables courants
Mélanome
§
Chez les patients qui ont reçu OPDIVO en monothérapie à raison de 3 mg/kg lors de l’étude CA209066, les e ets indésirables le plus fréquemment
signalés (taux ≥ 15 %) ont été la fatigue, les nausées, la diarrhée, le prurit et le rash*.
CPNPC
§ Chez les patients qui ont reçu OPDIVO en monothérapie à raison de 3 mg/kg lors des études CA209017† et CA209057‡, les réactions indésirables
au médicament le plus fréquemment signalées (taux ≥ 10 %) ont été la fatigue, les nausées, le rash et la diminution de l’appétit. La majorité
des réactions indésirables au médicament étaient légères ou modérées (grade 1 ou 2).
§ Les e ets indésirables les plus fréquents (signalés chez au moins 10 % des patients) pendant l’étude CA209063 étaient la fatigue, la diminution
de l’appétit, les nausées, la diarrhée et le rash§.
* CA209066 – Étude de phase III à répartition aléatoire et à double insu menée auprès de patients âgés de 18 ans et plus ayant reçu un diagnostic confi rmé de mélanome à gène
BRAF
de type
sauvage de stade III ou IV n’ayant jamais été traités et présentant un indice de performance ECOG (Eastern Cooperative Oncology Group) de 0 ou 1. Un total de 418 patients ont été répartis
aléatoirement pour recevoir soit le nivolumab administré par voie intraveineuse sur 60 minutes à raison de 3 mg/kg toutes les 2 semaines (n = 210), soit la dacarbazine à raison de 1 000 mg/m2
toutes les 3 semaines (n = 208).
† CA209017 – Étude de phase III à répartition aléatoire, ouverte, menée auprès de patients atteints d’un CPNPC squameux métastatique dont la maladie avait progressé pendant ou après une
bichimiothérapie antérieure à base de platine et présentant un indice de performance ECOG (Eastern Cooperative Oncology Group) de 0 ou 1. Un total de 272 patients ont été répartis au hasard
pour recevoir OPDIVO (n = 135) administré par voie intraveineuse à raison de 3 mg/kg toutes les 2 semaines ou le docetaxel (n = 137) administré par voie intraveineuse à raison de 75 mg/m2 toutes
les 3 semaines.
‡ CA209057 - Étude de phase III à répartition aléatoire, ouverte, menée auprès de patients atteints d’un CPNPC non squameux métastatique dont la maladie avait progressé pendant ou après
une bichimiothérapie antérieure à base de platine pouvant comprendre un traitement d’entretien et présentant un indice de performance ECOG (Eastern Cooperative Oncology Group) de 0 ou 1.
Un total de 582 patients ont été répartis au hasard pour recevoir OPDIVO (n = 292) administré par voie intraveineuse à raison de 3 mg/kg toutes les 2 semaines ou le docetaxel (n = 290)
administré par voie intraveineuse à raison de 75 mg/m2 toutes les 3 semaines.
§ CA209063 – Étude de phase II ouverte menée auprès de 117 patients atteints d’un CPNPC localement avancé ou métastatique qui avaient reçu deux types de traitement antérieurs ou plus.
Qu’est-ce
qu’OPDIVO?
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
1
/
32
100%