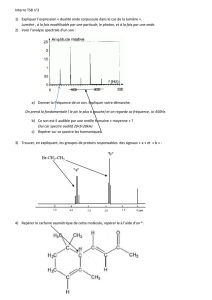
Introduction à la spectrométrie

Société Astronomique du Valais Romand Page 1
________________________________________________________________________________
Lors du dernier article, nous avons vu que la nature
nous offrait trois genres de spectres : le spectre conti-
nu, le spectre d'émission et le spectre d'absorption. La
question fondamentale qui s'est posée : comment la
nature fabrique ces spectres ?
1. La série de Balmer
En 1885, Angström mesura les 4 longueurs d'onde
émises (ou absorbées) par l'atome d'hydrogène dans le
visible. Il trouva
Hα = 6563 A = 656,3 nm
Hβ = 486,1 nm
Hγ = 434 nm
Hδ = 410,2 nm
Introduction à la spectrométrie
Quatrième partie : la fabrication d'un spectre par Alain Kohler
Le physicien suisse Johan Jakob Balmer (1825-
1898) mis en évidence que ces 4 longueurs d'onde
satisfaisaient à la relation empirique suivante :
1 / λ = G (n2 – 4) / n2
où λ est la longueur d'onde observée,
G une constante de ces 4 longueurs d'onde
et n prenant ici les valeurs entières de 3, 4, 5 et 6
(mais il y en a d'autres).
Johan Jakob
Balmer
Cette relation fut généralisée en 1888 par le physi-
cien suédois Johannes Rydberg (1854-1919) puis
réinterprétée au début du 20ème siècle par le suisse
Walter Ritz (natif de Sion en 1878 ! Notons qu'on
commémorera cette année le 100ème anniversaire de
sa mort) selon la formule :
1 / λ = RH ( 1 / p2 - 1 / n2 )
La série de Balmer
Walter Ritz
où RH est appelée constante de Rydberg et p et n
deux entiers naturels avec n supérieur à p. La série de
Balmer correspond à p = 2.
Cette formule est vérifiée par la découverte en 1906
de la série de Paschen (p = 3) et entre 1906 et 1914
de la série de Lyman (p = 1), en 1922 de la série de
Brackett (p = 3) et en 1924 de celle de Pfund (p = 4).
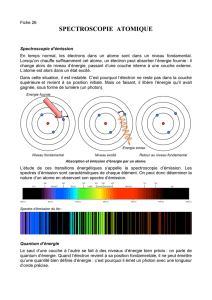
2. Le modèle de l'atome
Joseph John Thomson (1856-1940), qui découvrit
en 1897 l'électron, proposa en 1904 un modèle de
l'atome : celui est une sorte de pudding de charges
positives et négatives. En 1909, sous la conduite de
Ernest Rutherford (1871-1937), une expérience mit
en évidence la déviation de particules alpha par des
couches très fines de matière, ce qui lui permit de
conclure que l'atome est formé d'un noyau très petit
par rapport à sa dimension
donnée par le cortège électro-
nique.
Rutherford propose alors en
1911 un modèle de l'atome de
« type planétaire » : les élec-
trons, comme des planètes,
tournent autour du noyau, le
« soleil », beaucoup plus mas-
sif qu'eux.

Société Astronomique du Valais Romand Page 2
________________________________________________________________________________
Toutefois ce modèle planétaire de l'atome ne
résista pas aux apports de l'électrodyna-
misme qui prédit un rayonnement de l'élec-
tron dans sa révolution autour du noyau et
par ce fait une perte d'énergie de l'électron et
un « effondrement » de celui-ci sur le noyau.
Pour y remédier, le physicien danois Niels
Bohr (1885-1962) proposa les compléments
suivants .
a) Il existe certaines orbites dites stables où
l'électron de rayonne aucune énergie. Ces
orbites sont quantifiées : elles ne forment pas
un continuum dans l'espace, autrement dit, et
contrairement à la gravitation, seules certai-
nes orbites stables sont possibles.
b) Le rayonnement fournit par l'électron
n'apparaît que quand celui-ci passe d'une or-
bite haute à une orbite basse. Corollairement
il peut absorber du rayonnement en passant
d'une orbite basse à une orbite haute.
En quantifiant (discrétisant) le mouvement
cinétique de l'électron (une grandeur liée à la
révolution de cet électron autour du noyau),
Bohr arrive à quantifier les énergies de l'élec-
tron dans l'atome d'hydrogène :
En = - 13,6 / n2
(énergie exprimée en électron-volt ou eV)
Selon sa deuxième proposition le rayonne-
ment émis a une fréquence f donnée par :
h f = En - Ep = 13,6 ( 1 / p2 - 1 / n2)
avec h = constante de Planck. En considérant
que la longueur d'onde est inversement pro-
portionnelle à la fréquence f, on retrouve
bien ici la formule de Rydberg-Ritz.
On peut donc admettre que les électrons sont
à des niveaux quantifiés d'énergie et que
l'énergie du photon émis ou absorbé corres-
pond à une différence de ces niveaux d'éner-
gie réalisée donc lors de la transition d'un électron d'un niveau à
un autre niveau.
Il est à noter que le modèle de l'atome d'hydrogène, s'il corres-
pond assez bien aux observations, ne fut correctement affiné et
expliqué que dans le cadre de la mécanique quantique.
Niels Bohr
L'atome d'hydrogène en énergie
L'atome d'hydrogène en longueur d'onde

Société Astronomique du Valais Romand Page 3
________________________________________________________________________________
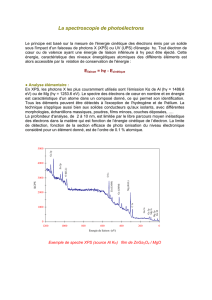
Le spectre d'émission et d'absorption
On peut donc maintenant comprendre les spectres
discrets (deux dernières lois de Kirchhoff) : un gaz
chaud, à basse pression, émet un nombre fini de cou-
leurs bien spécifiées. Une couleur précise est pro-
duite par une transition particulière d'un électron
d'une couche haute vers une couche basse : l'électron
en « tombant » perd de l'énergie et par principe de
conservation de l'énergie, cette énergie se transforme
ici en rayonnement. On peut par ailleurs comprendre
qu'il faille un gaz chaud pour l'émission d'un spec-
tre : les électrons « chauffés » sont alors portés à un
haut niveau d'énergie (couches hautes) ce qui leur
permet alors de « tomber » et émettre un rayonne-
ment. Corollairement, un spectre d'absorption appa-
raît plutôt avec un gaz « froid ».
Mais alors comment justifier un spectre d'absorp-
tion ? En effet, imaginons que du gaz absorbe un
rayonnement d'une certaine couleur. L'électron se
voit passer à une énergie plus haute. Mais il va alors
spontanément descendre à un niveau plus bas. Si
bien qu'on pourrait imaginer qu'il y a autant d'ab-
sorption que d'émission et le processus global est
nul. Pour un gaz en équilibre thermique, c'est bien ce
qui se passe ! Mais c'est un problème de géométrie
… En effet, admettons qu'un faisceau de lumière
(spectre continu) soit envoyé en direction d'un obser-
vateur 1. ll traverse un gaz peu dense, se fait absor-
ber puis réémettre. Mais l'émission se fait dans tou-
tes les directions et en fait très peu des couleurs ab-
sorbées sont réémises dans la direction de l'observa-
teur 1. Celui-ci perçoit ce manque en terme de spec-
tre d'absorption. L'observateur en 2 voit par contre
un spectre en émission mais avec des raies d'intensi-
tés faibles.
Le spectre continu
Si on a affaire un gaz chaud et à haut pression, les
photons émis vont rentrer en collisions de manière
très fréquente avec les atomes et vont ainsi être ther-
malisés : on rencontrera alors une émission globale
avec toutes sortes de longueurs d'onde, distribution
spectrale en forme de cloche correspondant à celle
du corps noir. Pour émettre un tel rayonnement, un
corps doit donc être suffisamment opaque. Un nuage
ténu d'hydrogène chaud n'émet qu'un spectre discret.
Il est à noter que l'atmosphère ténu d'une étoile peut
produire des raies spectrales, ce qui fait en sorte que
le spectre d'une étoile est en général une combinai-
son d'un spectre de corps noir et d'un spectre de
raies.
Le spectre d'absorption
___________________________________________________________________________________________
1
/
3
100%