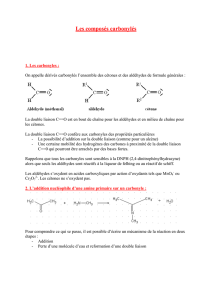
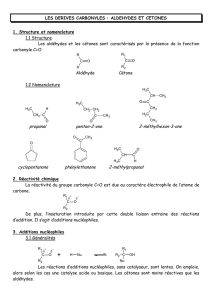
Chimie 6h suite

Thème 2 : Sens d’évolution spontanée d’une réaction, aspects
thermodynamique et cinétique.
A) CHAPITRE 3 : Classement des réactions et réaction complètes,
incomplètes ou impossibles.
Rappel :
Une réaction est complète lorsqu’au cours de la réaction au moins un des
réactifs réagit complètement.
Une réaction est incomplète lorsqu’au cours de la réaction aucun des réactifs
ne réagit complètement.
Une réaction est impossible lorsqu’aucun des réactifs ne réagit.
B) CHAPITRE 4 : vitesse d’une réaction chimique complète et lente
1) Mise en situation
2) Appropriation du concept : réaction rapide et réaction lente.
3) Appropriation du concept : vitesse moyenne d’une réaction chimique
4) Recherche des facteurs cinétiques
5) Exercices
1) Mise en situation
Le problème de durée d’une réaction est souvent crucial pour l’industrie chimique
mais aussi dans les domaines tels que l’alimentation, la biochimie, …
Il est donc important d’avoir une idée sur la rapidité de la réaction avant
d’enclencher un processus quelconque.
2) Appropriation du concept : réaction rapide et réaction lente
Une réaction est rapide si sa durée est inférieure à la seconde.
Une réaction est lente si sa durée excède la seconde et est de l’ordre de la
minute.
Une réaction est très lente si la durée est de l’ordre de grandeur de l’heure ou
du jour.
3) Appropriation du concept : vitesse moyenne d’une réaction chimique.
Pour suivre l’évolution d’un système réactionnel, on étudie, au cours du
temps, la variation de la concentration exprimée en mol/l d’un produit formé,
ce produit restant dans le milieu réactionnel.
Appelons C1 et C2 les concentrations d’un produit. Par analogie avec le cours
de physique, nous pouvons définir une vitesse moyenne de formation du
produit entre les instants t1 et t2 par :

=
Cette vitesse moyenne s’exprime en mol/l/s si la concentration est exprimée
en mol/l et le temps en seconde.
Nous venons de définir la vitesse moyenne de formation d’un produit lors
d’une réaction chimique. Nous pouvons aussi suivre l’évolution de la
concentration d’un réactif qui disparait au cours de la même réaction.
Il faut noter que puisque la concentration du réactif diminue au cours du
temps, dans ce cas, la variation de concentration C est négative (C1 > C2).
Par analogie avec les vitesses de formation, on peut aussi définir une vitesse
moyenne de disparition d’un réactif.
=
4) Recherche des facteurs cinétiques
Nous avons déjà signalé que certains facteurs peuvent modifier la durée d’une
réaction chimique et par conséquent sa vitesse. Quels sont-ils ?
Influence de la température
- la vitesse d’une réaction chimique croît d’une manière importante avec la
température
- cette vitesse, dans de nombreuses réactions, peut doubler pour chaque
augmentation de 10°C.
C’est pour cette raison que la température peut influencer la cuisson ou la
conservation des aliments.
Cuisson Les marmites à pression permettent de cuire plus rapidement les aliments
car la température est d’environ 112°C, or que dans une casserole ordinaire, la
température est de 100°C. Cette différence de plus de 10°C permet d’expliquer que
la cuisson des aliments se fait au moins 2X plus vite.
Conservation Certains aliments se dégradent assez vite : pour conserver les
aliments, il faut diminuer la vitesse de réaction chimique qui provoque leur
dégradation. En diminuant la température, on diminue donc la vitesse de réaction.
Influence d’un catalyseur
catalyseur : ce sont des corps que l’on peut introduire dans le milieu
réactionnel mais qui n’appartiennent pas à l’équation bilan mais qui
augmentent la vitesse de réaction chimique.
Le catalyseur :
- modifie la vitesse de réaction chimique
- se trouve inchangé en fin de réaction ; n’apparait donc pas dans l’équation
bilan

- est souvent spécifique du type de réaction dans lequel il est engagé
exemple de catalyseur : les enzymes.
Influence de la concentration initiale d’un ou des réactifs.
Lors d’une réaction chimique, la vitesse de formation d’un produit augmente
si l’on fait croître la concentration molaire d’un réactif.
Conclusion
Les facteurs cinétiques susceptibles de modifier la vitesse d’une réaction
chimique sont entre autres :
- la température
- la présence de catalyseur
- la concentration molaire d’un ou des réactifs
5) Exercices
p. 89
p. 90
C) CHAPITRE 5 : Réactions de précipitation et de neutralisation
Réaction de précipitation et solubilité
1) Mise en situation
2) Appropriation du concept : solubilité
3) Notion de composé soluble ou peu soluble
4) Ecriture des équations traduisant les réactions de précipitation
5) Exercices
Réaction de neutralisation
1) Mise en situation
2) Appropriation du concept : neutralisation
3) Interprétation de la réaction de neutralisation à la lumière des définissions
d’Arrhenius.
4) Exercices
Réaction de précipitation et solubilité
1) Mise en situation

Il arrive fréquemment qu’un composé solide appelé « précipité » se forme au cours
de mélanges de solutions aqueuses ou au sein même d’une solution aqueuse.
2) Appropriation du concept : solubilité
La raison pour laquelle ce composé solide apparait lors d’une réaction, est que ce
composé est peu soluble dans l’eau.
La solubilité et la précipitation sont donc liées.
La solubilité et son expression
Le terme solubilité désigne donc la masse maximale de soluté dissoute, à
température donnée, par unité de volume de solution saturée.
La solubilité s’exprime en g/l
s =
ou en mol/l
s =
(n’oublions pas que n =
pour passer d’une écriture à l’autre.)
Notion de composé soluble ou peu soluble
Par convention, sont considérés comme :
- solubles, les composés dont la solubilité est supérieur à 0,1 mol/l de solution.
- peu solubles ou insolubles, les composés dont la solubilité est inférieure à 0,1
mol/l de solution saturée.
(voir tableau p. 193)
5) Écriture des équations traduisant les réactions de précipitation
Écritures ioniques
ex :
La réaction à lieu au niveau des ions : se sont les ions acteurs.
Les ions
ne participent pas à la réaction et ne varient donc pas à
la fin de cette réaction : ce sont les ions spectateurs.
Écriture ionique simplifiée
Les ions spectateurs peuvent donc être supprimés dans l’écriture précédente.
On obtient ainsi :
Cette écriture est :
- beaucoup plus significative car elle indique uniquement la transformation
qui a lieu au cours de la réaction.
- beaucoup plus générale car elle n’indique pas l’origine des ions acteurs.

Écriture moléculaire
L’avantage de cette écriture est de faire ressortir la nature exacte des réactifs
et des produits formés.
Pour passer de l’écriture ionique à l’écriture moléculaire, il suffit d’associer aux
ions acteurs les ions spectateurs dans des proportions telles que l’on obtienne
des molécules électriquement neutres.
On obtient ainsi :
6) Exercices
P. 96
P. 98
P. 100
P. 101
P. 102
La réaction de neutralisation
1) Mise en situation
Dans ce chapitre, nous parlerons principalement « d’antiacides » qui ont pour rôle
de neutraliser le surplus d’acide produit par les cellules pariétales des cryptes
gastriques (abus d’alcool, stress, …)
2) Appropriation du concept : neutralisation
La réaction au cours de laquelle un acide neutralise une base ou vice-versa
s’appelle une réaction de neutralisation.
(Voire labo)
3) Interprétation de la réaction de neutralisation à la lumière des définitions
d’Arrhenius.
Arrhenius postule que les ions présents dans la solution acide réagissent avec les
ions présents dans la solution basique pour former des molécules d’eau selon
l’équation :
Chaque H+ libéré par l’acide réagit avec chaque OH- libéré par la base, pour
produire de l’eau, l’autre composé formé étant un sel.
4) Exercices
 6
6
 7
7
 8
8
1
/
8
100%