Nom, Prénom, Classe :

Nom, Prénom, Classe :
Terminale S :
Interrogation n°4 (1/2h)
A/ Un peu de cours
Q1. Spectroscopie UV-visible (doc 1.)
A quelles conditions peut-on étudier une molécule par spectroscopie UV-Visible ?
...……………………………………………………………………………………………………………………...………………………………………………..
……………………………………………………………………………………………………………………...………………………………………………...
……………………………………………………………………………………………………………………...………………………………………………...
Que signifie « faire le blanc » d’un spectrophotomètre ?
...……………………………………………………………………………………………………………………...………………………………………………..
……………………………………………………………………………………………………………………...………………………………………………...
……………………………………………………………………………………………………………………...………………………………………………...
Voici le spectre UV-visible d’une solution diluée contenant l’ion
[Fe(SCN)]2+
(aq).
Compléter ce spectre avec les grandeurs figurant en abscisse et en
ordonnée ainsi que leurs unités.
Quelle est la couleur de la solution contenant l’ion [Fe(SCN)]2+
(aq). Bien justifier et faire apparaitre d’éventuelles
constructions graphiques clairement.
...……………………………………………………………………………………………………………………...………………………………………………..
……………………………………………………………………………………………………………………...………………………………………………...
……………………………………………………………………………………………………………………...………………………………………………...
……………………………………………………………………………………………………………………...………………………………………………...
Q2. Spectre IR / RMN
Quelles sont les informations apportées par spectre IR ?
……………………………………………………………………………………………………………………...………………………………………………...
……………………………………………………………………………………………………………………...………………………………………………...
Est-ce suffisant pour déterminer la structure d’une molécule ?
……………………………………………………………………………………………………………………...………………………………………………...
……………………………………………………………………………………………………………………...………………………………………………...
Par quelle méthode d’analyse spectrale faut-il compléter cette analyse ?
……………………………………………………………………………………………………………………...………………………………………………...
…………
.
…………
.

B/ Associer une molécule à son spectre infrarouge
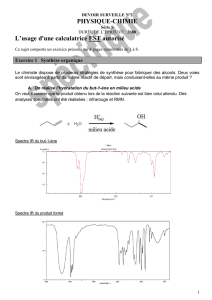
Le spectre infrarouge d’un composé organique A de formule brute C5H10O est donné ci-dessous.
Q1. Le composé A possède-t-il à priori des liaisons (voir tables doc2.) :
Ctet—H ? Ctri—H ? O—H ? C=O ? C=C ?
……………………………………………………………………………………………………………………...………………………………………………...
……………………………………………………………………………………………………………………...………………………………………………...
……………………………………………………………………………………………………………………...………………………………………………...
……………………………………………………………………………………………………………………...………………………………………………...
……………………………………………………………………………………………………………………...………………………………………………...
……………………………………………………………………………………………………………………...………………………………………………...
……………………………………………………………………………………………………………………...………………………………………………...
Q2. Lequel des deux composés suivants peut-être le composé A : pentanal ou pent-4-èn-1-ol ? (donner la
formule semi-développée de ces deux molécules et bien justifier).
……………………………………………………………………………………………………………………...………………………………………………...
……………………………………………………………………………………………………………………...………………………………………………...
……………………………………………………………………………………………………………………...………………………………………………...
……………………………………………………………………………………………………………………...………………………………………………...
……………………………………………………………………………………………………………………...………………………………………………...
……………………………………………………………………………………………………………………...………………………………………………...
……………………………………………………………………………………………………………………...………………………………………………...
Q3. Vérifier en travaillant sur la bande d’absorption à 3300 cm-1 que l’on travaille bien dans l’IR puis
déterminer à quelle fréquence correspond cette bande d’absorption.
……………………………………………………………………………………………………………………...………………………………………………...
……………………………………………………………………………………………………………………...………………………………………………...
……………………………………………………………………………………………………………………...………………………………………………...
……………………………………………………………………………………………………………………...………………………………………………...
……………………………………………………………………………………………………………………...………………………………………………...

C/ Relier un spectre de RMN à une molécule
Le spectre de RMN d’un composé organique A de formule brute C4H8O est donné ci-contre.
Le composé A peut-il être de la butanone ?
Données : voir tables doc 3.
...……………………………………………………………………………………………………………………...………………………………………………..
……………………………………………………………………………………………………………………...………………………………………………...
……………………………………………………………………………………………………………………...………………………………………………...
……………………………………………………………………………………………………………………...………………………………………………...
……………………………………………………………………………………………………………………...………………………………………………...
……………………………………………………………………………………………………………………...………………………………………………...
……………………………………………………………………………………………………………………...………………………………………………...
……………………………………………………………………………………………………………………...………………………………………………...
……………………………………………………………………………………………………………………...………………………………………………...
……………………………………………………………………………………………………………………...………………………………………………...
……………………………………………………………………………………………………………………...………………………………………………...
……………………………………………………………………………………………………………………...………………………………………………...
……………………………………………………………………………………………………………………...………………………………………………...
……………………………………………………………………………………………………………………...………………………………………………...
……………………………………………………………………………………………………………………...………………………………………………...
……………………………………………………………………………………………………………………...………………………………………………...
……………………………………………………………………………………………………………………...………………………………………………...
……………………………………………………………………………………………………………………...………………………………………………...
……………………………………………………………………………………………………………………...………………………………………………...
……………………………………………………………………………………………………………………...………………………………………………...

Document 1 : cercle chromatique
Document 2 : bandes d’absorption en infrarouge (IR)

Document 3 : déplacement chimique δ des protons en RMN
 6
6
 7
7
 8
8
1
/
8
100%