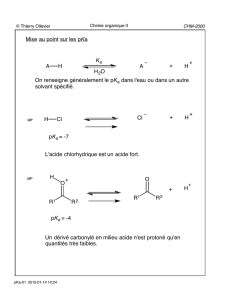
Aromatiques - Département de chimie

© Thierry Ollevier CHM-2000
Chimie organique II
Alkylation de Friedel-Crafts intramoléculaire
H
AlCl3HCl
+
Cl
H
Alkylations de Friedel-Crafts au départ d'autres précurseurs de
carbocations
!Au départ d'alcools
OH
OH
H
O
H
Exemple 1
H2SO4
CH3CH2
CH3CH2OH2
H
- H2O
aromatiques-21 2017-01-12 17:10

© Thierry Ollevier CHM-2000
Chimie organique II
HH
H
HO BF3
H
OH
BF3, 60°C, 9 h
OH
BF3
O
H
BF3
formation du carbocation II :
36 %
Exemple 2
- H2O
aromatiques-22 2017-01-12 17:11

© Thierry Ollevier CHM-2000
Chimie organique II
!Au départ d'alcènes
H
Exemple 1
H2SO4
H
H
H
H
H
HHSO4
aromatiques-23 2017-01-12 17:11

© Thierry Ollevier CHM-2000
Chimie organique II
H
H F
H
H
H
H
H
H
H
F
Exemple 2
H
HF, 0°C
aromatiques-24 2017-01-12 17:11

© Thierry Ollevier CHM-2000
Chimie organique II
Limitations à l'alkylation de Friedel-Crafts
H
!Polyalkylation
Br
FeBr3
!Réarrangements de carbocations
!Polyalkylation
H
25 %15 %
H
+
Le premier produit d'alkylation Friedel-Crafts subit lui-même une seconde
alkylation.
Explication :
H
Le noyau benzénique est enrichi en électrons (effet inductif donneur +I
du premier groupe isopropyle). L'isopropylbenzène est donc plus réactif
pour une attaque électrophile que le benzène lui-même.
En résumé, les alkylations de Friedel-Crafts peuvent être réalisées
avec n'importe quel produit de départ, tel qu'un alcool ou un alcène,
pour autant qu'il puisse fonctionner comme précurseur d'un carbocation.
- HBr
aromatiques-25 2017-01-12 17:12
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
1
/
20
100%