Numéro 29 - Amplifon

LA PRISE EN CHARGE DE LA PATHOLOGIE
THYROÏDIENNE EN 2016
Numéro spécial coordonné par le Docteur Diane Lazard
Service de chirurgie cervico-faciale et ORL, Institut Arthur-Vernes, Paris
LE JOURNAL ORL
Revue d’information scientifique et technique
DÉCEMBRE 2016 – JANVIER 2017 – N°29


4- Recommandations pour la prise en charge
des nodules thyroïdiens en 2016
Dr Diane Lazard1,2,3, MD, PhD.
1
Service de chirurgie cervico-faciale et ORL, Institut Arthur Vernes, Paris
2
Service de chirurgie générale, viscérale et endocrinienne, Hôpital de
la Pitié-Salpêtrière, Université Pierre et Marie Curie (Paris 6), Paris
3
Professeur assistant honoraire à l’Université médicale de Nottingham,
Royaume-Uni
6- Nouveautés en échographie : le score TI-RADS
peut-il éviter la cytoponction ?
Dr Gilles Russ, radiologue
Centre de Pathologie et d’Imagerie, Paris 14e et Hôpital Pitié-Salpêtrière,
Paris
8- Maladies dysimmunitaires de la thyroïde.
Quand proposer une chirurgie ?
Comment la préparer ?
Dr Monique Vincens 1,2,3, endocrinologue
1
Institut Arthur-Vernes, Paris
2
Centre Luxembourg, Paris
3
Institut Cochin, Inserm U 1016, Paris
12- Les thyroïdectomies minimales invasives.
Vidéo Assistée et Robot Assistée :
Quelle place aujourd’hui ?
Dr Yoann Pons
Professeur agrégé du Val-de-Grâce
Service ORL, Hôpital d’instruction des armées Percy, Clamart
13- Irathérapie : modalités et informations
pratiques à délivrer au patient et à sa
famille
Dr Cécile Ghander
Unité Thyroïde – Tumeurs endocrines, Hôpital Pitié-Salpêtrière, Paris
15- Carcinome médullaire de la thyroïde.
Du dépistage au traitement
Pr Christophe Trésallet
Service Chirurgie générale à orientation endocrinienne et gynécologique,
Hôpital Pitié-Salpêtrière, Paris
17- Dysphonies postopératoires après chirurgie
thyroïdienne. Le cas particulier du nerf
laryngé supérieur
Diane Lazard1,2,3, MD, PhD.
1
Service de chirurgie cervico-faciale et ORL, Institut Arthur Vernes, Paris
2
Service de chirurgie générale, viscérale et endocrinienne, Hôpital de
la Pitié-Salpêtrière, Université Pierre et Marie Curie (Paris 6), Paris
3
Professeur assistant honoraire à l’Université médicale de Nottingham,
Royaume-Uni
22- Responsabilité médicale. Cas d’experts
Pr Bruno Frachet
Service ORL, Hôpital Rothschild, Paris
Maître Caroline Kamkar
Docteur en droit, Cabinet d’avocats, 7, rue Saint-Sauveur, Lille
27- Quoi de neuf en ORL ?
Dr Isabelle de Gaudemar
Phnom Penh, Cambodge
29- Le Monde d’Amplifon
Septièmes rencontres O.R.Elles
Dr Martine François
Service ORL, Hôpital Robert Debré, Paris
40- Un peu de divertissement :
Les mots croisés de
la pathologie thyroïdienne
Pr Bruno Frachet
Service ORL, Hôpital Rothschild, Paris
Sommaire Éditorial
LA PATHOLOGIE THYROÏDIENNE.
ÉVOLUTIONS DIAGNOSTIQUES
ET THÉRAPEUTIQUES
La chirurgie thyroïdienne représente 46 000 actes par an en France
(http://stats.atih.sante.fr). Le geste opératoire en lui-même est
partagé par plusieurs spécialités chirurgicales et a bénéficié de progrès
techniques récents tels que le monitorage des nerfs récurrents
et, plus récemment, des nerfs laryngés supérieurs, la chirurgie
vidéo-assistée et robot-assistée. L’indication chirurgicale et le choix
d’éventuels traitements complémentaires en cas de tumeur maligne
ou de complications fonctionnelles sont le fruit d’une coopération
entre endocrinologues, radiologues échographistes, scintigraphistes,
anatomopathologistes, médecins nucléaires, chirurgiens et phoniatres.
Ce numéro du Journal ORL est une illustration de la diversité
de la prise en charge de la pathologie thyroïdienne et de la bonne
collaboration entre toutes les spécialités. Ainsi, seront abordés les
indications chirurgicales en cas de nodules bénins et malins, les
nouvelles classifications échographiques – les scores TI-RADS –, la
prise en charge médicale des pathologies dysimmunitaires, la chirurgie
minimale invasive, la conduite à tenir devant un carcinome médullaire
de la thyroïde, le déroulement du traitement complémentaire par
iode radioactif et, enfin, la prise en charge de la dysphonie post-
thyroïdectomie, en prenant soin dans chaque cas d’aborder les
nouveautés technologiques.
Bonne lecture !
Dr Diane Lazard
© iStock-Sakramir
Coordination du Journal ORL :
Professeur Bruno Frachet,
Service ORL, Hôpital Rothschild, Paris

Recommandations pour la prise en
charge des nodules thyroïdiens en 2016
Diane Lazard1,2,3, MD, PhD.
1. Service de chirurgie cervico-faciale et ORL, Institut Arthur Vernes, Paris
2. Service de chirurgie générale, viscérale et endocrinienne, Hôpital de la Pitié Salpêtrière, Université Pierre et Marie
Curie (Paris 6), Paris
3. Professeur assistant honoraire à l’Université médicale de Nottingham, Royaume-Uni
Un nodule est défini comme une hypertrophie localisée
du tissu thyroïdien. Il peut être isolé ou au sein d’un goître
multi-hétéro-nodulaire (GMHN). C’est une pathologie
à prédominance féminine avec entre 3 et 9 femmes
concernées pour un 1 homme, soit moins de 2 % des
hommes dans la population générale et au moins 5 % des
femmes. Un nodule est cancéreux dans 5 % des cas, quelle
que soit sa taille, et qu’il soit isolé ou au sein d’un GMHN1.
Les facteurs de risque de malignité d’un
nodule2
• L’âge inférieur à 16 ans ou supérieur à 65 ans ;
• un antécédent de carcinome dans la famille ou la notion
de néoplasie endocrinienne multiple de type II ;
• un antécédent de radiations ionisantes ;
• la rapidité d’évolution ;
• un aspect dur, fixé, et/ou irrégulier ;
• la présence d’une paralysie récurrentielle (PR) ou d’une
adénopathie.
Recommandations françaises
d’évaluation d’un nodule thyroïdien1
Elle est biologique, échographique et par cytoponction.
La biologie ne comprend que deux tests : la TSH et la
thyrocalcitonine.
Si la TSH est abaissée (hyperthyroïdie), une scintigraphie
à l’iode 123 est recommandée à la recherche d’un nodule
chaud. En cas de nodule chaud, la cytoponction n’est
pas nécessaire. Il faudra discuter un traitement par iode
radioactif ou chirurgie.
La thyrocalcitonine a pour but de dépister, en préopératoire,
un cancer médullaire de la thyroïde (CMT). En effet, la
prise en charge chirurgicale de ce type de tumeur est plus
agressive.
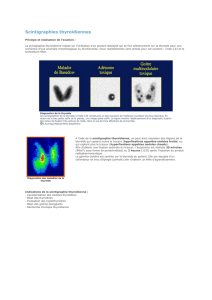
L’échographie doit comporter un schéma des nodules et
des ganglions, le cas échéant, et donner le score TI-RADS
des principaux nodules (cf. communication dédiée et figure
d’après la Société française d’endocrinologie).
La cytoponction est réalisée sous échographie pour des
nodules d’au moins 8-10 mm de plus grand axe. Elle n’est
pas indiquée si le nodule est inférieur à 8 mm, s’il est
purement kystique ou si le nodule est chaud. Son indication
peut être guidée par le score TI-RADS. Les résultats de la
cytoponction doivent être exprimés en faisant référence à
la classification de Bethesda.
Les indications chirurgicales1
Selon les recommandations françaises en vigueur, il est
licite de proposer un acte chirurgical, lobo-isthmectomie
ou thyroïdectomie totale dans les cas suivants :
• nodule de plus de 30 mm;
• nodule suspect de malignité à l’échographie et/ou à la
cytoponction, quelle que soit sa taille ;
• nodule chaud ;
• GMHN toxique à nodule(s) suspect(s) (un GMHN toxique
sans nodule suspect peut être également traité par
irathérapie à l’iode 131) ;
• GMHN chez le sujet jeune, pour éviter une surveillance
longue au cours de la vie. (À noter que la notion de «
jeune » n’est pas formellement précisée en termes d’âge
dans les recommandations.)
Une lobo-isthmectomie pourra être proposée en cas de
lobe controlatéral sain (pas de micronodule qui pourrait se
développer avec le temps), pas d’antécédents familiaux de
thyropathie. Le patient devra être prévenu et accepter un
suivi régulier du lobe restant et une réintervention possible
en cas d’évolution vers un GMHN ou nodule unique
volumineux. Il est à savoir que 20 % de ces patients auront
besoin d’une opothérapie substitutive par insuffisance de
sécrétion des hormones circulantes par le lobe restant. Dans
tous les autres cas, il est recommandé une thyroïdectomie
totale.

Le suivi en cas de non-indication
chirurgicale
Il est clinique et biologique (TSH uniquement), annuel, à la
recherche de signes de compression ou de malignité, de
dysimmunité.
Après le premier bilan échographique, une deuxième
échographie est réalisée à un an puis deux ans après. En
l’absence d’évolution clinique, l’échographie sera répétée
tous les cinq ans. Une cytoponction ne sera demandée
qu’en cas de modification clinique ou d’une augmentation
≥ 20 % du diamètre d’un nodule.
Prise en charge chirurgicale des cancers
différenciés
Les cancers papillaires représentent 90 % des cancers de
la thyroïde. Les formes vésiculaires (ou folliculaires) sont
inférieures à 10 %. La lymphophilie concerne principalement
les cancers papillaires. En effet, des adénopathies
métastatiques de la zone VI (centrale, récurrentielle) sont
retrouvées chez 50% des patients lors du diagnostic
initial. Les métastases osseuses et pulmonaires sont
plus fréquentes en cas de cancer vésiculaire, mais sont
également possibles en cas de cancer papillaire.
Tableau 1 : Rappel de la classification TNM des cancers différenciés de
la thyroïde (forme simplifiée) :
T1a ≤ 1 cm
T1b < 2 cm
T2 [2 – 4[ cm intraglandulaire
T3 ≥ 4 cm intraglandulaire
T4 extraglandulaire
Le microcarcinome représente les formes inférieures à
10 mm. On considère qu’il a un faible risque évolutif s’il est
unifocal et intrathyroïdien.
Recommandations françaises de la prise en charge des cancers différenciés (selon C. Trésallet, Traité de chirurgie endocrinienne 2015 et HAS 2010) :
Suspicion de cancer Lobectomie
+ examen extemporané
Négatif ou
Attendre définitif
Surveillance
+/- traitement hormonal
substitutif
Positif Thyroïdectomie totale
+/- geste ganglionnaire
Risque très faible
Surveillance
Risque faible /
intermédiaire / haut
Iode radioactif (I-131)
Modalités discutées en RCP
Très faible risque = microcancer unifocal et intrathyroïdien pT1a :
pas d’indication formelle à une totalisation en absence de nodule dans le lobe restant
Les sociétés savantes françaises recommandent une
thyroïdectomie totale, quelle que soit la taille du cancer,
sauf dans les microcancers unifocaux et intrathyroïdiens
(pT1a) sans nodule dans l’autre lobe et sans adénopathie.
En cas de forme papillaire, le geste ganglionnaire
sera thérapeutique en cas de ganglions suspects
(N+) cliniquement, ou confirmés en préopératoire
par échographie et/ou cytoponction (dosage de la
thyroglobuline in situ), ou confirmés en peropératoire par
examen extemporané. Un évidement du secteur VI central
sera réalisé de façon minimale, uni- ou bilatéral en fonction
de la taille de la tumeur ou d’adénopathies suspectes.
L’évidement latéral, homolatéral ou bilatéral des zones IIa,
III et IV est ajouté selon les données du bilan préopératoire
et de l’exploration peropératoire (par exemple : en cas
de positivité du secteur VI ou d’adénopathies latérales
constatées).
Un évidement prophylactique (en cas de N0) du secteur
VI central n’est pas recommandé de façon systématique
mais il peut être réalisé dès les stades T1 pour préciser
la classification TNM (statut N) et faciliter la surveillance
ultérieure. En revanche, redisséquer une loge VI à distance
du geste initial est source de morbidité importante pour le
nerf récurrent et les glandes parathyroïdes et se discute au
cas par cas.
En cas de carcinome vésiculaire qui ne soit pas multifocal
ou localement invasif, le geste ganglionnaire n’est pas
recommandé.
Pour comparaison, l’American Thyroid Association
20152 préconise une absence d’évidement pour les
formes papillaires T1 – T2 et N0 clinique. Un évidement
prophylactique (en cas de N0) de la zone VI est recommandé
pour les formes papillaires T3 – T4. Un évidement
thérapeutique sera réalisé en zone VI uniquement s’il existe
des adénopathies visibles cliniquement ; l’évidement
latéral ne sera réalisé que sur preuve histologique
d’envahissement ganglionnaire de ces zones (cytoponction
ou examen extemporané).
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
1
/
44
100%