Les mécanismes immuns associés à l`ITSL

9
Les CD
CD11b+/CD11c-
expriment
des taux
remarquablement
élevés de TLR2,
4, 5 et 7.
DOSSIER SCIENTIFIQUE
Les mécanismes immuns
associés à l’ITSL :
mise à jour
Une meilleure compréhension de la biologie des cellules dendritiques
sublinguales/buccales donne un meilleur aperçu des mécanismes
d’action associés à l’ITSL et ouvre la voie au développement de
vaccins anti-allergies de seconde génération.
Comprendre les mécanismes
de l’ITSL
L’immunothérapie sublinguale (ITSL) spécifi-
que des allergènes est un traitement sûr, efficace
et durable des allergies respiratoires de type I
chez les adultes comme chez les enfants [1,2].
Les mécanismes immuns associés à l’ITSL
sont en train d’être déchiffrés et ils suggèrent
que les réponses des cellules T spécifiques
d’allergènes sont cruciales dans l'induction de
tolérance par voie sublinguale [3]. Des études
ont montré que, durant l’immunisation sublin-
guale, l'allergène est capté par les cellules den-
dritiques de Langerhans buccales qui possèdent
des propriétés tolérogènes uniques [4,5].
Dans un tel contexte, nous avons entrepris une
caractérisation détaillée desdites cellules den-
dritiques sublinguales/buccales (CD) chez la
souris BALB/c.
Caractérisation des sous-groupes
de cellules dendritiques tolérogènes
dans les tissus buccaux de la souris
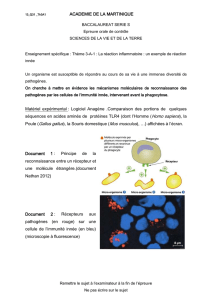
Des analyses immuno-histologiques et par
cytométrie en flux ont été réalisées en utilisant
des anticorps dirigés contre divers marqueurs
de surface des CD. Trois sous-groupes de CD
buccales présentant une distribution cellulaire
bien distincte ont été identifiés (figure1, partie
gauche), parmi lesquels :
• des CD de Langerhans CD207+, situées
dans la muqueuse même ;
• une sous-population prédominante de CD
myéloïdes CD11b+/CD11c- et CD11b+
/CD11c+ CD, situées à l’interface muqueuse
/sous-muqueuse ;
• des CD plasmacytoïdes B220+/120G8+, au
niveau des tissus sous-muqueux.
Les CD myéloïdes ou plasmacytoïdes bucca-
les, isolées après traitement des tissus buccaux
par collagénase et purifiées par tri cellulaire,
conservent leur aptitude à capter, dégrader et
présenter l’allergène aux lymphocytes T (LT)
CD4+ in vitro. De telles CD buccales sont en
mesure d’orienter les réponses des LT CD4+
vers la production d’interféron-gamma (IFNγ)
et d’interleukine 10 (IL10) (soit une réponse des
cellules Th1 et, probablement, des cellules T
régulatrices).
Les CD myéloïdes buccales CD11b+
/CD11c+ et les CD plasmacytoïdes B220+
/120G8+ présentent un profil d'expression du
récepteur TLR étendu, semblable à celui
observé chez leurs homologues spléniques.
Fait intéressant: les CD CD11b+/CD11c-, qui
Tri cellulaire
Tissus buccaux
Quantité relative / bêta-actine
0
TLR1/6
TLR2
TLR3
TLR4
TLR5
TLR7
TLR9
TLR2
TLR3
TLR4
TLR5
TLR7
TLR9
TLR1/6
2
4
6
8
10
12
14
16
CD11b+, rate CD11b+ buccales
Muscle
Sous-muqueuse
Muqueuse CD11b
■Figure 1. Caractérisation des CD myéloïdes buccales

représentent, sur le plan quantitatif, le princi-
pal sous-groupe de cellules buccales présen-
tatrices d’antigène, expriment des niveaux
remarquablement élevés de TLR2, 4, 5 et 7
(figure 1, partie droite).
Signalons que, comme le précise J.P. Allam
(cf. page 11), lorsque les CD buccales de
Langerhans sont stimulées par l’intermédiaire
du TLR4, elles stimulent également la pro-
duction d’IFNγet d’IL10 par les LT CD4+,
suggérant là une propriété générale des CD
buccales [5]. C’est pourquoi les systèmes de
libération qui ciblent les CD buccales, ainsi
qu’une sélection d’agonistes de TLRs utilisés
comme adjuvant, en association avec les aller-
gènes, pourraient tous deux présenter un inté-
rêt pour améliorer l’induction de la tolérance
durant l’ITSL.
Implications cliniques pour
l’immunothérapie sublinguale
Nous avons testé divers formulations et adju-
vants dans un modèle murin d’immunothéra-
pie sublinguale. Dans ce modèle, des souris
BALB/c sont sensibilisées à l’ovalbumine (OVA)
et présentent donc une hyperréactivité bron-
chique (HRB) facilement détectable, associée
à des index de Penh élevés (mesurés par plé-
thysmographie du corps entier), comparative-
ment à des souris saines (figure 2). Après
ITSL par OVA soluble, une réduction mineure
de l’HRB est observée (figure 2). Il est intéres-
sant de remarquer que le fait de cibler l'OVA
vers les CD buccales grâce à des nanoparti-
cules polysaccharidiques (PSC) muco-adhé-
sives, ou d’administrer l’antigène avec des
agonistes TLR2 ou TLR4 (Pam3CSK4, OM-
294-BA-MP ou des probiotiques sélection-
nés comme Lactobacillus plantarum), améliore
considérablement l’induction de la tolérance
par voie sublinguale (figure 2) [6-8]. Associés
à ces améliorations, de tels systèmes de libé-
ration ou agonistes des TLR favorisent égale-
ment la production d'IFNγ/IL10 par LT CD4+
naïfs, en drainant les ganglions lymphatiques
cervicaux après l’ITSL [7,8].
Dr L. Mascarell, Antony (France)
1. Wilson DR, Lima MT, Durham SR. Sublingual immunotherapy
for allergic rhinitis : systematic review and meta-analysis.
Allergy
2005 ; 60: 4-12.
2. Didier A, Malling HJ, Worm M, Horak F, Jager S, Montagut A,
et al.
Optimal dose, efficacy, and safety of once-daily
sublingual immunotherapy with a 5-grass pollen tablet for
seasonal allergic rhinitis.
J Allergy Clin Immunol
2007 ; 120 :
1338-45.
3. Moingeon P, Batard T, Fadel R, Frati F, Sieber J, Van Overtvelt L.
Immune mechanisms of allergen-specific sublingual
immunotherapy.
Allergy
2006 ; 61 : 151-65.
4. Allam JP, Novak N, Fuchs C, Asen S, Berge S, Appel T,
et al
.
Characterization of dendritic cells from human oral mucosa :
a new Langerhans' cell type with high constitutive
FcepsilonRI expression.
J Allergy Clin Immunol
2003 ; 112 :
141-8.
5. Allam JP, Peng WM, Appel T, Wenghoefer M, Niederhagen B,
Bieber T
et al
. Toll-like receptor 4 ligation enforces
tolerogenic properties of oral mucosal Langerhans cells.
J Allergy Clin Immunol
2008 ; 121 : 368-74 e1.
6. Razafindratsita A, Saint-Lu N, Mascarell L, Berjont N, Bardon
T, Betbeder D
et al
. Improvement of sublingual
immunotherapy efficacy with a mucoadhesive allergen
formulation.
J Allergy Clin Immunol
2007 ; 120 : 278-85.
7. Van Overtvelt L, Lombardi V, Razafindratsita A, Saint-Lu N,
Horiot S, Moussu H
et al
. IL-10-Inducing Adjuvants Enhance
Sublingual Immunotherapy Efficacy in a Murine Asthma
Model.
Int Arch Allergy Immunol
2007 ; 145 : 152-62.
8. Mascarell L, Van Overtvelt L, Lombardi V, Razafindratsita A,
Moussu H, Horiot S
et al
. A synthetic triacylated pseudo-
dipeptide molecule promotes Th1/TReg immune responses
and enhances tolerance induction via the sublingual route.
Vaccine
2007 ; 26 : 108-18.
10
DOSSIER SCIENTIFIQUE
Indice de Penh (%)
Souris sainesSouris
sensibilisées
à l’OVA
ITSL
avec OVA
soluble
ITSL
avec OVA
soluble
+
TLR2
ITSL avec
OVA soluble
+
TLR4
ITSL avec
OVA soluble
+
TLR2/4
ITSL
avec
OVA/PSC
0
20
40
60
100
80
■Figure 2. Évaluation des divers formulations
et adjuvants sublinguaux chez les souris sensibilisées
à l’OVA.
Nos données confirment que les CD
sublinguales/buccales sont orientées
vers l’induction de tolérance, en induisant
les réponses des cellules Th1 et proba-
blement des cellules T régulatrices Tr1.
Il convient donc de développer spécifi-
quement des vaccins sublinguaux de
seconde génération afin de mieux cibler
les allergènes vers les CD buccales dans
le contexte des signaux médiés par le
TLR, afin d’augmenter la production
d’IFN
γγ
/IL10 par les cellules T CD4+.

Expressions: Est-il légitime de considé-
rer la muqueuse buccale comme un
organe tout à fait spécifique et privilé-
gié en termes de réponse immunitaire?
DRJ.-P. ALLAM :
Effectivement, ses caractéristi-
ques immunitaires sont tout à fait spécifiques
et distinctes de celles des autres muqueuses de
l’organisme. Deux types de constatations mon-
trent bien que, sur le plan immunitaire, la
muqueuse buccale a des propriétés principa-
lement inductrices de tolérance vis-à-vis des
allergènes :
• d’une part, alors que la microflore buccale est
caractérisée par une colonisation microbienne
particulièrement importante, les infections
bactériennes aiguës sont rares et peu sévè-
res dans cette localisation ;
• d’autre part, la fréquence des réactions aller-
giques au niveau buccal est très faible com-
parativement aux autres épithéliums de revê-
tement de l’organisme, tels que la peau, la
muqueuse nasale et l’épithélium pulmonaire.
Expressions: Quelles sont les princi-
pales différences entre les cellules de
Langerhans buccales (CLb) et les cel-
lules de Langerhans épidermiques ?
DRJ.-P. ALLAM :
Ces différences résident non seu-
lement dans la distribution des immunorécep-
teurs acquis, tels que les récepteurs à haute affi-
nité pour les immunoglobulines E (Fc epsilon
R1), mais concernent également les récep-
teurs caractéristiques du système immunitaire
inné, tels que les Toll-like receptor 4 (TLR 4).
Expressions: Quel est le rôle joué par
les TLR4 ?
DRJ.-P. ALLAM :
L’expression des TLR4 à la sur-
face des CLb humaines permettent à ces cellu-
les de répondre à divers allergènes bactériens issus
de la microflore buccale, et notamment aux lipo-
polysaccharides des membranes bactériennes.
Le comportement immunologique des CLb a
été analysé en utilisant des ligands du TLR4. Il
a ainsi été montré que sous l’effet de l’activa-
tion du TLR4, ces cellules acquièrent un phé-
notype tolérogène, exprimant des marqueurs
impliqués dans l’induction de tolérance, tels
que B7H1 et B7H3. La production d’interleu-
kine est également stimulée.
Des expériences de cocultures de CLb et de lym-
phocytes T ont permis de démontrer que l’acti-
vation des TLR4 est à l’origine de l’induction de
cellules T tolérogènes qui, non seulement produi-
sent des niveaux élevés de TGF bêta, mais aussi
expriment le facteur de transcription foxp3.
Certains composants bactériens de la microflore
buccale pourraient exercer un effet de régula-
tion négative de la réponse immune, par le
biais des récepteurs TLR4. De tels ligands des
TLR4 pourraient être une voie de recherche
prometteuse dans la perspective du dévelop-
pement des adjuvants pour l’optimisation de
l’immunothérapie sublinguale.
Expressions:Quelles sont les conséquen-
ces de l’activation des Fc epsilon R1?
Celles-ci sont encore mal connues. Cependant,
des résultats préliminaires ont montré que l’ac-
tivation de ces récepteurs caractéristiques de
l’immunité acquise pourrait :
• déclencher l’induction de la production de
cytokines tolérogènes telles que l’interleu-
kine-10 (IL-10) ou le TGF bêta ;
• stimuler le recrutement de lymphocytes T
régulateurs, par le biais de la production de
chimiokines telles que CCL17 et CCL22.
11
Des ligands
des TLR4
pourraient
être ciblés
dans la
perspective du
développement
des adjuvants
pour
l’optimisation
de l’ITSL.
La conjonction de ces propriétés, liées
aux récepteurs Fc epsilon R1 et TLR4,
font des cellules de Langerhans de la
muqueuse buccale des acteurs immunitai-
res particulièrement adaptés pour capter
et transporter les antigènes au cours de
l’immunothérapie sublinguale.
Focus: La biologie des cellules
de Langerhans buccales
Interview du Dr Jean-Pierre ALLAM, université de Bonn (Allemagne)
1
/
3
100%