Chapitre n°3 – Les solutions

Chapitre n°3 – Les solutions
I) Qu’est-ce qu’une solution ?
a) Solution, soluté et solvant
Une solution est obtenue par dissolution d’un soluté dans un solvant. Lorsque le solvant est l’eau, la
solution est appelée solution aqueuse.
Exemple : On dissout du chlorure de sodium dans de l’eau. On obtient une solution aqueuse de
chlorure de sodium. Ici le soluté est le chlorure de sodium et le solvant est l’eau.
b) Dissolution d’une espèce moléculaire ou ionique
Parfois lors d’une dissolution, le soluté peut se présenter sous forme de molécule ou sous forme
d’ions.
Par exemple, lors de la dissolution du saccharose C
12
H
22
O
11
(s), le soluté est présent sous forme de
molécules de formule C
12
H
22
O
11
(aq).
Lors de la dissolution du chlorure de sodium NaCl(s), le soluté est présent sous la forme d’ions
chlorure Cl
-
(aq) et d’ions Na
+
(aq).
Une solution peut contenir des molécules ou des ions.
c) Solution saturée
Pour une température donnée, il existe une masse maximale de soluté que l’on peut dissoudre pour
préparer une solution.
Par exemple on ne peut pas dissoudre plus de 357 g de chlorure de sodium pour disposer d’une
solution d’un litre à 25 °C. Au-delà de cette masse, le chlorure de sodium ne se dissous plus et la
solution est saturée.
Une solution est saturée lorsque le soluté introduit ne peut pas être totalement dissous.
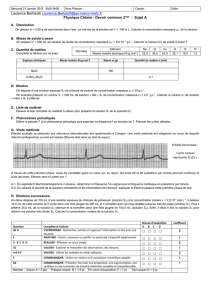
II) Qu’est-ce qu’une concentration ?
a) Concentration massique ou teneur massique
Dans le TP n°4 – Vérifier la concentration d’une espèce chimique dans un médicament.
On parle de la concentration en ions permanganate
-
4
MnO
qui est de 10 mg.L
-1
, cela correspond
donc à la masse en ions permanganate pour un litre de solution.
La concentration massique (ou teneur massique) d’une espèce chimique est la masse de cette
espèce chimique dissoute dans un litre de solution. Elle s’exprime en gramme par litre (g.L
-1
)
Remarque : On utilise aussi des sous-multiples, par exemple le milligramme par litre :
1 mg.L
-1
= 10
-3
g.L
-1

Si m est la masse d’une espèce chimique dissoute dans une solution de volume V, l’expression de la
concentration massique c
m
est :
m
m
c
V
=
soit :
m
m c V
= ×
b) Concentration molaire
La concentration molaire d’une espèce chimique est la quantité de matière de cette espèce
chimique dissoute dans un litre de solution. Elle s’exprime en mole par litre (mol.L
-1
)
Si n est la quantité de matière d’une espèce chimique dissoute dans une solution de volume V, alors
l’expression de la concentration molaire c est :
n
c
V
=
soit
n c V
= ×
c) Relation entre quantité de matière, masse, volume et concentrations
En connaissant la masse molaire d’une espèce chimique, on peut passer de la concentration
massique à la concentration molaire et réciproquement :
m
m n M n
c M c M
V V V
×
= = = × = ×
Donc :
m
c c M
= ×
soit
m
c
c
M
=
m
: la masse en gramme (g)
V : le volume en litre (L)
c
m
: la concentration massique en gramme par litre (g.L
-1
)
n
: la quantité de matière en mole (mol)
V : le volume en litre (L)
c : la concentration en mole par litre (mol.L
-1
)
M
: la masse molaire en gramme par
mole (g.mol
-
1
)
cm : la concentration massique en gramme par litre (g.L
-1
)
c : la concentration en mole par litre (mol.L
-1
)
1
/
2
100%