2nde Santé Activité : Préparer une solution par dilution La perfusion

2nde Santé
Activité : Préparer une solution par dilution
La perfusion est en fait une injection lente, prolongée et continue, à l'intérieur d'une veine
(intraveineuse) le plus souvent, d'une quantité importante de sérum, de sang ou de
substances médicamenteuses en solution (soluté).
Les perfusions intraveineuses ont pour but l'administration de substances indispensables à
la vie d'un patient. Elles sont incontournables dès lors que le patient ne peut plus rien absorber
par voie orale (impossibilité de passer par le tube digestif).
Les substances administrées sont (liste non exhaustive) :
- du sodium, sous forme d’ions Na+ provenant souvent d’une solution de chlorure de sodium.
- du potassium
- du glucose (soluté glucosé)
- des lipides
- des acides aminés
- des dérivés sanguins.
La solution qui nous intéresse dans cette activité est une solution de chlorure de sodium.
On donne :
Masse molaire atomique (en g.mol-1) : M(Na) = 23 M(Cl) = 35,5
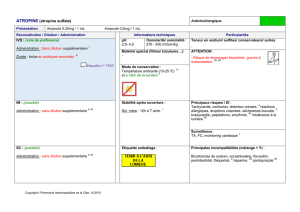
CHLORURE DE SODIUM 0.9 % MACOPHARMA, solution pour perfusion
La substance active est :
Chlorure de sodium NaCl …………………………………………………………..9,00 g pour 1 L
Ions présents :
Chlorure Cl-
Sodium Na+
Ce médicament est préconisé dans les cas suivants :
- la rééquilibration ionique (apport en sels minéraux),
- le traitement des états de déshydratations,
- le traitement des hypovolémies (baisse brutale du volume du sang total de l’organisme),
- d’être utilisé comme véhicule pour apport thérapeutique (permettant le passage de traitements par voie veineuse).
Cette solution pour prfusion a déjà été préparée et se trouve sur la paillasse du professeur.
1. Quelle est la masse mNaCl de NaCl nécessaire pour faire 1L de solution ?
2. Quelle est la quantité de matière nNaCl correspondante ? Effectuer les calculs ci-dessous.
3. Selon les patients, les enfants par exemple, la concentration de la solution sera plus petite. Il est donc nécessaire de
diluer (ajouter du solvant) cette solution de départ, appelée en chimie solution mère pour obtenir une solution fille
de concentration plus faible.
Le professeur va tout d’abord vous montrer comment diluer cette solution mère pour obtenir un volume de 100 mL
d’une solution fille dix fois moins concentrée.
2nde : Dilution 1/2

4. Calculs préliminaires :
Vous réaliserez ensuite la dilution suivante :
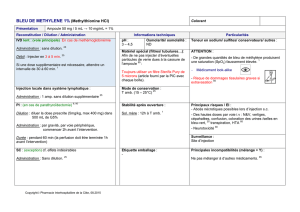
Solution mère S0 :
Concentration molaire C0 = 0,154 mol.L-1
Volume V0 à prélever (à calculer) :
Solution fille désirée :
Concentration molaire Cf = 3,08.10-2 mol.L-1
Volume final Vf = 100 mL
a) Pour savoir quel est le facteur de cette dilution, calculer le rapport
Error!
.
b) Question très importante :
Lors de la dilution, on prélève un certain volume V0 de la solution mère qui contiendra une certaine quantité de
matière de soluté notée n. Ensuite, on rajoute de l’eau distillée pour diluer la solution.
Est-ce qu’on change la quantité de matière n de soluté pendant la dilution ? Justifier.
c) Ecrire la relation entre la quantité de matière n de soluté et C0 et V0.
d) Ecrire la relation entre cette même quantité de matière n de soluté et Cf et Vf.
e) En déduire la relation entre Cf , Vf , C0 , et V0 .
f) D’après la formule précédente, calculer le volume V0 de solution mère à prélever pour obtenir la solution-fille
désirée.
4. Réaliser la dilution de la solution-mère afin d’obtenir la solution-fille désirée.
2nde : Dilution 2/2
1
/
2
100%