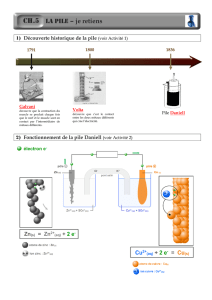
Pile Volta et Daniell

Activité C 9-1
La pile de Volta et la pile de Daniell
La pile de Volta ( 1745-1827)
Elle était constituée (dans sa forme finale) de lames de zinc et de lames de cuivre en contact avec de l'eau additionnée
généralement d'acide sulfurique (Volta utilisa initialement une solution de saumure). Volta empila alternativement un
disque de zinc, un carton imbibé d'eau acidifiée et un disque de cuivre. Cette pile produisait un courant et constitua une
des découvertes les plus importantes dans l'étude de l'électricité. On pensait alors que cette pile durerait indéfiniment sans
que l'on ait besoin de la recharger. Cette conjecture était bien entendu fausse car les réactions chimiques qui ont lieu dans
la pile électrochimique ne peuvent pas se produire indéfiniment. Volta croyait aussi que c'était seulement la tension de
contact entre deux métaux différents qui était à l'origine du courant. Celle-ci existe, mais elle est très faible. En réalité,
dans une pile électrochimique, ce sont les réactions chimiques entre les métaux et la solution dans laquelle ils baignent
qui sont à l'origine de la circulation du courant.
On se rendit vite compte qu'une telle pile ne fournissait pas un courant constant. La tension aux bornes de la pile de
Volta débitant sur une résistance extérieure tendait assez rapidement vers zéro. Plusieurs causes sont à l'origine de cette
baisse (on les regroupe sous la dénomination générale de "polarisation") : modification de la composition de l'électrolyte
au cours de la réaction électrochimique, formation d'hydrogène sur la lame de cuivre qui tend à augmenter la résistance
intérieure de la pile, notamment.
Une pile présentant de tels défauts ne pouvait donc pas avoir d'applications pratiques.
On commença donc par essayer de réduire les effets nuisibles dus à la présence de bulles d'hydrogène autour de
l'électrode de cuivre par agitation de la solution ou brossage : ce n'était ni vraiment très pratique ni très efficace.
C'est pourquoi d'autres approches furent tentées.
La pile de Daniell ( 1790-1845)
Daniell se pencha sur le processus électrochimique
dont la pile Volta est le siège. Celle-ci étant formée
d'une lame de zinc et d'une lame de cuivre trempant
dans une solution d'acide sulfurique dilué. Il était
normal de penser qu'il pouvait se former du sulfate de
zinc. Mais l'hydrogène ? On savait depuis longtemps
que le zinc attaqué par l'acide sulfurique donne un
dégagement d'hydrogène, mais que si l'on touche le zinc
trempant dans la solution d'acide avec une tige de
cuivre, d'argent ou de platine, l'hydrogène n'apparaît
plus sur le zinc mais bien sur l'autre métal. Daniell
explique ce phénomène en admettant que l'ion sulfate se
combine aux cations zinc résultant de la dissolution de
l'anode, mais que les deux protons H+ de l'acide
sulfurique se portent sur le cuivre où ils se déchargent
pour donner de l'hydrogène. Daniell remarqua aussi que,
lorsqu'on plonge l'électrode de cuivre dans une solution
contenant un sel de cuivre, du cuivre métallique se
dépose sur cette électrode de cuivre.
C'est ainsi que Daniell eut l'idée de faire de même pour
la pile zinc/cuivre, ce qui avait pour effet d'éviter ce
fâcheux dégagement d'hydrogène et cette polarisation
dont nous avons parlé plus haut : ce fut donc à la suite
de ces remarques que la pile Daniell fut mise au point.
Il s'agissait donc de mettre au point un protocole
expérimental efficace et de créer une pile dont
l'utilisation fût relativement commode. Daniell eut l'idée
de fabriquer une pile à deux compartiments séparés par
une cloison poreuse : d'un côté de l'acide sulfurique
dilué, de l'autre une solution de sulfate de cuivre.
Daniell employa d'abord comme cloison poreuse des
gosiers de bœuf, puis, plus tard, des plaques de faïence
non vernissée dont on pouvait mieux contrôler la pureté
et dont la durée de fonctionnement était plus grande.
Ce fut Moritz Hermann Von Jakobi qui eut l'idée de
remplacer la solution d'acide sulfurique par une solution
de sulfate de zinc pour aboutir à la pile de Daniell
classiquement présentée dans les ouvrages
d'électrochimie : en effet, selon Jakobi, lorsque le cuivre
se dépose sur l'électrode, une quantité équivalente
d'anions sulfate est libérée, et cette quantité peut
s'associer exactement aux cations zinc résultant de la
dissolution de l'anode de zinc.
La pile de Daniell (ou si l'on préfère celle modifiée par
Jakobi) avait l'avantage d'être simple à construire. Elle
resta en usage (par exemple en télégraphie) pendant
longtemps. Du fait de la constance de sa tension, elle
servit de pile étalon dans les laboratoires comme dans
l'industrie.
Pierre Bianco
"De la pile de Volta à la conquête de l'espace"
Questions :
1. Volta souhaitait appeler son appareil : "organe électrique artificiel" (référence au poisson torpille qui peut produire
des décharges électriques). Pourquoi la postérité l'a-t-il désigné sous le nom de "pile" ?
2. Un élément de pile Volta zinc / eau acidifiée / cuivre a une f.é.m. de l'ordre de 0,3V.
La pile présentée par Volta comprenait 20 de ces éléments. Calculer sa f.é.m. Justifier votre calcul.
3. Quel était le principal défaut de la pile de Volta ?
4. Quel phénomène est à l'origine de la production du courant par la pile ?
5. Quelles peuvent être les couples d'oxydoréduction qui interviennent à chaque électrode dans une pile de type Volta
avec électrolyte acide ? Ecrire les demi équations électroniques puis la réaction chimique modélisant cette
transformation.
6. Même question pour la pile de Daniell.
7. Schématiser la pile de Daniell modifiée par Jakobi et préciser, lorsque le circuit est fermé, les réactions aux
électrodes, le déplacement des espèces en solution et le sens de passage du courant dans la pile.
1
/
1
100%