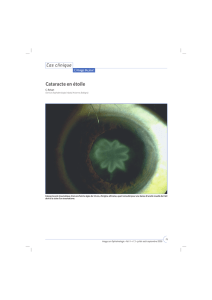
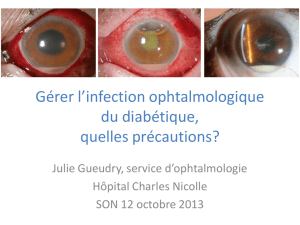
Endophtalmies après opération de la cataracte

UNIVERSITE DE GENEVE FACULTE DE MEDECINE
Section de Médecine Clinique
Département des Neurosciences Cliniques et
Dermatologie
Clinique et Policlinique d’Ophtalmologie
Thèse préparée sous la direction du Professeur P. M. Leuenberger, professeur honoraire
ENDOPHTALMIES APRES OPERATION DE LA
CATARACTE
THESE
présentée à la Faculté de Médecine de l’Université de Genève pour obtenir le grade de Docteur
en Médecine
par
Danielle MARIE-ANNE
de
Stein (AR)
THESE N°
Genève, 2003


Remerciements
A mon Directeur de Thèse, Monsieur le Professeur Peter LEUENBERGER, Professeur
d’ophtalmologie, Ancien Chef de Service Adjoint d’ophtalmologie de l’Hôpital Cantonal
Universitaire de Genève ;
Vous m’avez fait l’honneur de me confier ce travail et permis de le mener à bien en me
prodiguant vos conseils et vos jugements précieux.
Soyez assuré assure de ma vive considération.
A Monsieur le Professeur André ROTH, Professeur d’ophtalmologie, Ancien Chef de Service
d’ophtalmologie de l’Hôpital Cantonal Universitaire de Genève ; J’ai pu admirer durant mon
assistanat et à travers votre enseignement, vos qualités de clinicien et de pédagogue. L’occasion
m’est offerte ici de vous exprimer ma reconnaissance et ma très grande estime.
A Monsieur le Professeur Aviroam B. SAFRAN, Professeur d’ophtalmologie, Chef de Service
d’ophtalmologie de l’Hôpital Cantonal Universitaire de Genève
L’occasion m’est offerte ici de vous exprimer ma profonde considération pour la qualité de vos
enseignements et l’inaltérable ferveur avec laquelle vous les dispensez.
Je dédie ce travail :
A ma famille, en la remerciant pour son affection bienveillante et confiante.
A ma sœur Lydie pour son soutien et sa grande participation à la réalisation de ce travail.
A mes amis, pour leur attention et écoute patiente et compréhensive.
Je remercie également l’ensemble des membres du personnel du Service
d’Ophtalmologie de l’Hôpital Cantonal Universitaire de Genève pour leur accueil, leur
gentillesse et leur aimable collaboration durant ces années d’assistanat.
Que ce travail leur exprime ma plus profonde reconnaissance pour l’aide qu’ils n’ont
jamais manqué de m’apporter et leur assure de mon amical souvenir.

Résumé
Après une revue de la littérature sur l’endophtalmie, nous présentons une étude qui a pour objet
l’analyse rétrospective des endophtalmies aiguës après opération de la cataracte à la clinique
ophtalmologique de Genève de 1972 à 2000, en mettant l’accent sur le type de chirurgie
pratiquée et la présence d’un implant intraoculaire.
Sur les 18 225 opérations de la cataracte, nous avons pu mettre en evidence, l’incidence de
l’endophtalmie en fonction de la technique chirurgicale et de l’implantation. Si l’incidence
globale d’endophtalmie de 0,3% est la même que celle publiée dans la littérature, il semble que,
dans notre étude, la phacoémulsification soit associée à une incidence plus élevée
d’endophtalmies de 0,45%, ainsi que l’implantation d’une lentille intra-oculaire que l’on
retrouve chez 89% des yeux infectés.

SOMMAIRE
ASPECTS THÉORIQUES DE
L’ENDOPHTALMIE
I) INTRODUCTION 1
II) DEFINITION ET CLASSIFICATIONS 2
1) Définition générale 2
2) Définition bactériologique 2
3) Définition clinique 2
4) Classification 3
a) En fonction du mode de contamination
b) En fonction de la chronologie
III) EPIDEMIOLOGIE 5
1) Historique : 1900 – 1975 5
a) Incidence
b) Evolution clinique
2 )Période moderne : 1975 – 2000 6
a) Incidence globale
b) Incidence en fonction du type de chirurgie
c) Facteur de risque
IV) MECANISME DE DEFENSE DE L’ŒIL CONTRE L’INFECTION 11
1) Les moyens para-immunologiques 11
a) Paupières
b) La peau
c) Surface oculaire
d) La flore conjonctivale
e) Le mucus
2) Les moyens immunologiques 13
a) Complément
b) Immunoglobulines
3) L’altération de ces moyens de défense 14
V) SOURCE DE L’INFECTION 15
1) Locale 15
2) Exogène 17
VI) LES GERMES RESPONSABLES DES ENDOPHTALMIES
18
1) Bactéries causales 18
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
1
/
123
100%