Anémie ferriprive/anémie inflammatoire

LES MARQUEURS FERRIQUES
Anémie ferriprive/anémie inflammatoire :
comment faire la différence ?
Galinier A., Beyne-Rauzy O., Caspar-Bauguil S., Stebenet M.,
Thouvenot J.P., Périquet B., Adoue D.
INTRODUCTION
Depuis plusieurs millénaires, nombre de savants et médecins (Hippocrate, Mélampos)
ont présumé l’importance du matériau « fer » dans le maintien de la santé. Ainsi, les soldats
romains et grecs buvaient l’eau de rafraîchissement de leur armure pour avoir force et vigueur
durant la bataille. Le terme « martial » fait référence à Mars, dieu de la force et de la guerre.
C’est à partir du 18ème siècle que la prescription de fer se répand pour traiter le syndrome
anémique qui associe pâleur, asthénie chez la jeune femme et le nouveau-né. Au 19ème siècle,
la découverte de l’hémoglobine permet de donner un support physiopathologique à l’anémie.
Depuis quelques années, les progrès dans le domaine de l’hématologie, de la biochimie et de
la nutrition ont permis d’affiner les connaissances sur le métabolisme du fer dans l’organisme.
Le dépistage de la carence en fer, de stockage et/ou fonctionnelle, est actuellement facilité par
le dosage d’indicateurs plus spécifiques et plus sensibles (récepteur soluble de la transferrine),
le fer sérique n’ayant plus de valeur biologique.
Dans des conditions normales d’alimentation, le pool endogène en fer constitué est très peu
dépendant des apports exogènes. En théorie, on ne devrait pas rencontrer de carence en fer,
d’autant que les besoins journaliers sont peu importants. Cependant, le déficit en fer touche
environ 15% de la population française (23% des femmes réglées, 60% des femmes enceintes,
2% des hommes). Dans les pays occidentalisés, le défaut d’apport en fer, observé dans des
groupes de population à risque, est fortement lié à l’évolution du mode d’alimentation. La
réduction des apports énergétiques, volontaire ou adaptative, et les processus agroalimentaires
conduisant à des aliments sources de « calories vides » limitent les apports en vitamines,
minéraux et oligoéléments.
SOURCES ET BESOINS
Le fer est présent dans presque tous les aliments. Sa biodisponibilité est directement
liée à la forme chimique dans laquelle il se présente dans l’aliment : fer non héminique de
faible biodisponibilité (3 à 8% absorbés) et fer héminique de meilleure biodisponibilité (10 à
25% absorbés). L’absorption du fer non héminique est fortement dépendante des composants
alimentaires. Ainsi les supports protéiques (volaille, poissons…) et les acides organiques
réducteurs (vitamine C) favorisent l’absorption. Celle-ci est par contre limitée par des
chélateurs comme les fibres ou les sels de calcium. L’absorption du fer lié à l’hème des
produits animaux est indépendante des autres constituants alimentaires.
Les besoins pour la population française sont de 10 mg de fer par jour pour l’homme adulte,
et de 15 mg pour la femme réglée. Ces besoins sont fortement augmentés pendant la
grossesse.
METABOLISME
Les propriétés métaboliques du fer sont liées à ses fonctions d’oxydo-réduction. Le fer
« de passage », en transfert, est sous forme réduite (Fe2+, fer ferreux), il est alors oxydé par
des oxydases ou la céruloplasmine (Fe3+, fer ferrique) pour être transporté (transferrine) ou
stocké (ferritine).
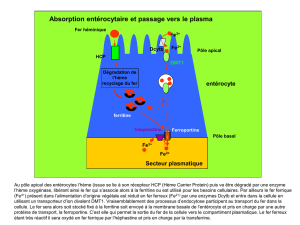
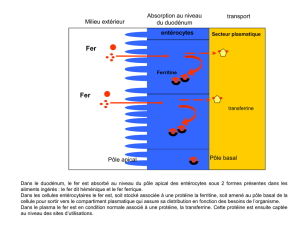
Le fer alimentaire est sous forme oxydé et doit être réduit (vitamine C, réductase)
pour être absorbé au niveau du duodénum. Seul 1 à 2 mg de fer de la ration alimentaire

quotidienne sont absorbés. La ferroportine est une protéine de transfert du Fe2+ du cytosol de
l’entérocyte ou du macrophage vers le sang, dont l’action est régulée par l’hepcidine. L’
héphaestine comme la céruloplasmine sont des oxydases du Fe2+ en Fe3+ transporté par la
transferrine. La transferrine, saturée en fer, est internalisée dans les cellules par
l’intermédiaire du récepteur à la transferrine, synthétisé par toutes les cellules de l’organisme.
Le récepteur soluble de la transferrine est une forme tronquée du récepteur de la
transferrine, dont le taux sérique circulant est proportionnel aux besoins en fer fonctionnel des
cellules. Le pool labile de Fe2+ intracellulaire est incorporé dans les structures fonctionnelles
fer-dépendantes spécifiques de la cellule. Le taux de Fe2+ cytosolique « restant » induit une
transduction adaptée aux besoins de la cellules en fer : des besoins accrus en fer
s’accompagne de la synthèse de récepteur de la transferrine, un excès de fer présent entraîne
la synthèse de ferritine pour le stockage. La ferritine est la protéine de stockage du fer de
toutes les cellules. La ferritine sérique est sécrétée par le foie, principal organe de stockage
du fer. L’hepcidine, de découverte récente (2001), est un peptide hormonal d’origine
hépatique qui limite l’absorption du fer et facilite la séquestration du fer dans le macrophage.
Sa présence est majorée au cours de l’inflammation et minorée en cas d’hypoxie et de déficit
en fer.
Absorption
duodénum, Fe2+, ferroportine, hepcidine
Transport
plasmatique
transferrine/Fe3+
Stockage
Foie, rate, ferritine/Fe3+
Recyclage
Fe2+ , ferroportine, hepcidine
macrophage rate,moelle osseuse,
Küpffer,
Fer intracellulaire: pool fer labile Fe2+:
hemoglobine, myoglobine, enz. Fer dépendant,
transduction IRP/IRE
récepteur de la transferrine, ferritine/Fe 3+
peroxydation moléculaire
hephaestine
ceruloplasmine
Fe3+ alimentaire
Vitamine C, réductase Absorption
duodénum, Fe2+, ferroportine, hepcidine
Transport
plasmatique
transferrine/Fe3+
Stockage
Foie, rate, ferritine/Fe3+
Recyclage
Fe2+ , ferroportine, hepcidine
macrophage rate,moelle osseuse,
Küpffer,
Fer intracellulaire: pool fer labile Fe2+:
hemoglobine, myoglobine, enz. Fer dépendant,
transduction IRP/IRE
récepteur de la transferrine, ferritine/Fe 3+
peroxydation moléculaire
hephaestine
ceruloplasmine
Fe3+ alimentaire
Vitamine C, réductase
(en gras : paramètres d’exploration biochimiques, en italique : molécules du métabolisme du
fer non encore accessibles à l’exploration biologique)
FER ET PATHOLOGIES
Les pathologies directement liées au métabolisme du fer ont trois origines principales:
le déficit, la surcharge et le stress oxydant. Une situation clinique complexe et fréquente est
l’anémie inflammatoire. En dehors de pertes excessives conduisant à un déficit, le turn-over
métabolique du fer est autoentretenu par son pool endogène. La surcharge, en relation avec
des mutations portant sur des protéines impliquées dans le transfert ou le stockage du fer,
conduit aux différentes formes d’hémochromatoses. Le fer, dans sa forme réduite et libre, est
potentiellement un puissant inducteur de stress oxydatif impliqué dans différents mécanismes

physiopathologiques. Enfin, l’état inflammatoire chronique génère un trouble de l’absorption
et de l’utilisation du fer.
Déficit en fer Surcharge en fer Stress oxydant
- anémie microcytaire,
hypochrome
- groupes à risque : nné,
enfant, 3ème trim.
grossesse, sujet âgé,
sportif haut niveau
- hémochromatose héréditaire :
. 40-50ans : HFE (très fq) ; RTF2
(rare) ; ferroportine (rare)
. juvénile 20-30 ans : HJV (rare) ;
hepcidine (exceptionnel)
- hémochromatose secondaire
. thalassémie
. transfusions répétées
- fibrose hépatique
- cancers (colique)
- athérosclérose
- maladie
d’Alzheimer,
Parkinson
anémie inflammatoire
EXPLORATION BIOCHIMIQUE
Les paramètres biologiques, sériques, actuels et praticables dans l’exploration du statut en
fer à retenir sont les suivants :
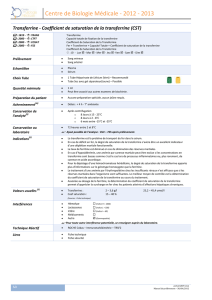
- ferritine: estimation des réserves en fer ; normales de 30 à 300 ng/ml ; variations en
fonction de l’âge et du sexe (B60 = 16,2 €)
- Récepteur soluble de la transferrine (TfRs): estimation du fer fonctionnel, du fer de
« passage » ; normales de 0.83 à 1.76 mg/l ; variations en fonction des âges extrêmes
de la vie, de la race (B60 = 16,2 €)
- Capacité totale de fixation de la transferrine (CTF) = transferrine ; normales de
1.75 à 3.00 g/l soit 45.7 à 73 µmol/l ; faibles variations en fonction de l’âge et du sexe
(B35 = 9,45 €)
- Coefficient de saturation de la transferrine (CS) = (fer sérique / transferrine) x
100 ; normale 30% (> 45% évocateur de surcharge) (CTF+CS = B65 = 17,55 €)
L’exploration du fer ne résume pas la physiopathologie d’une anémie, dans des formes
complexes, d’autres causes peuvent co-exister et nécessiter des dosages complémentaires de
vitamines B9, B12 et C.
Hiérarchie de prescription des examens :
La ferritinémie reste un indicateur de choix du stock en fer et le dosage de référence
pour le diagnostic des déficits ou des surcharges, en l’absence de syndrome inflammatoire.
Les autres paramètres biologiques d’appréciation de l’état du fer sont à envisager en fonction
du contexte clinique selon le tableau décisionnel ci-dessous :
Anémies
ferriprives Infections, inflammations chroniques
sans déficit fonctionnel Carences
fonctionnelles
ferritine CTF
CS
TfRs
↓
↑
↓↓
↑↑↑
N ou ↑
↓
↓
N ou ↓
N ou ↓
N
N ou ↓
↑↑
Des situations physiopathologiques plus complexes peuvent se présenter et pourront
être discutées au cours de la présentation orale.
1
/
3
100%