CHAPITRE 1: ORGANISATION NEURONALE
NEUROBIOLOGIE!
PARTIE 2: ORGANISATION NEURONALE, INFORMATIONS CÉRÉBRALES,
NEUROTRANSMISSION (I. LENA)!
!
CHAPITRE 1: ORGANISATION
NEURONALE!
!
I - COMMENT SONT ORGANISÉS LES
NEURONES?
•Le cerveau est constitué de 100 milliards de neurones et de 10 fois plus de cellules
gliales. Depuis plusieurs années, le rôle important des cellules gliales a été de plus en
plus mis en avant."
•La fonction première des neurones est de traiter l'information cérébrale et de faire en
sorte qu'elle soit communiquée d'un réseau à un autre réseau. Ces processus se font
sous forme électrique ou chimique."
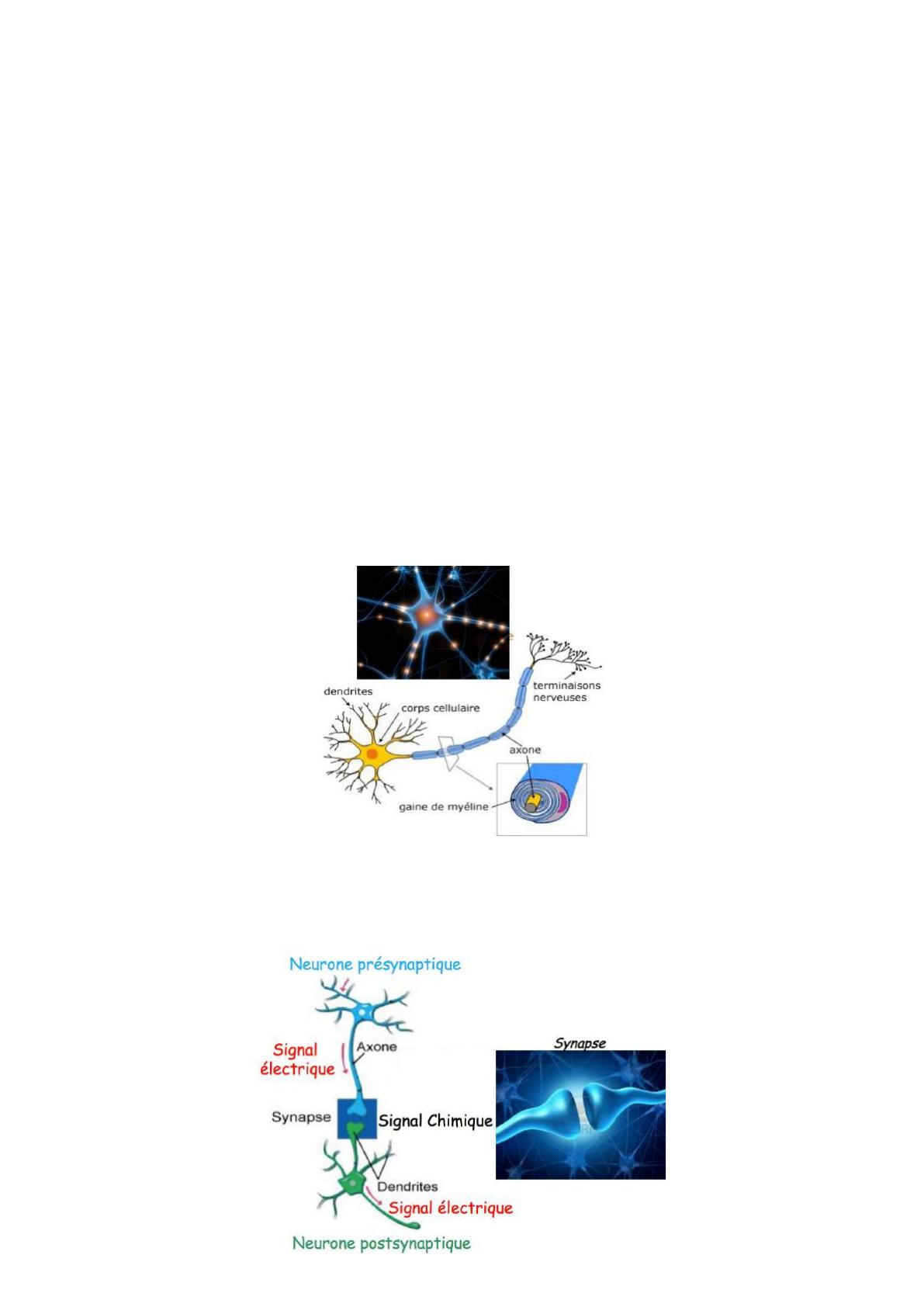
•Les neurones communiquent entre eux au niveau de synapses. "
•Les neurones projettent depuis leur corps cellulaire 2 types de prolongements: les
dendrites et les axones."
1
•Les synapses permettent la communication entre 2 neurones. On nomme: "
-neurone pré-synaptique le neurone situé avant le point de rencontre"
-neurone post-synaptique le neurone situé avant le point de rencontre."
•L’information dans le neurone pré-synaptique, sous forme de signal électrique, est
véhiculée jusqu'à la synapse, où elle est transformée en signal chimique. Elle est à
nouveau transformée#en signal électrique dans le neurone post-synaptique."
•Le nombre de synapses par neurone varie de 1 à 100 000. Ce nombre dépend de la
densité des prolongements du neurone (arborisation synaptique) et de son volume."
2
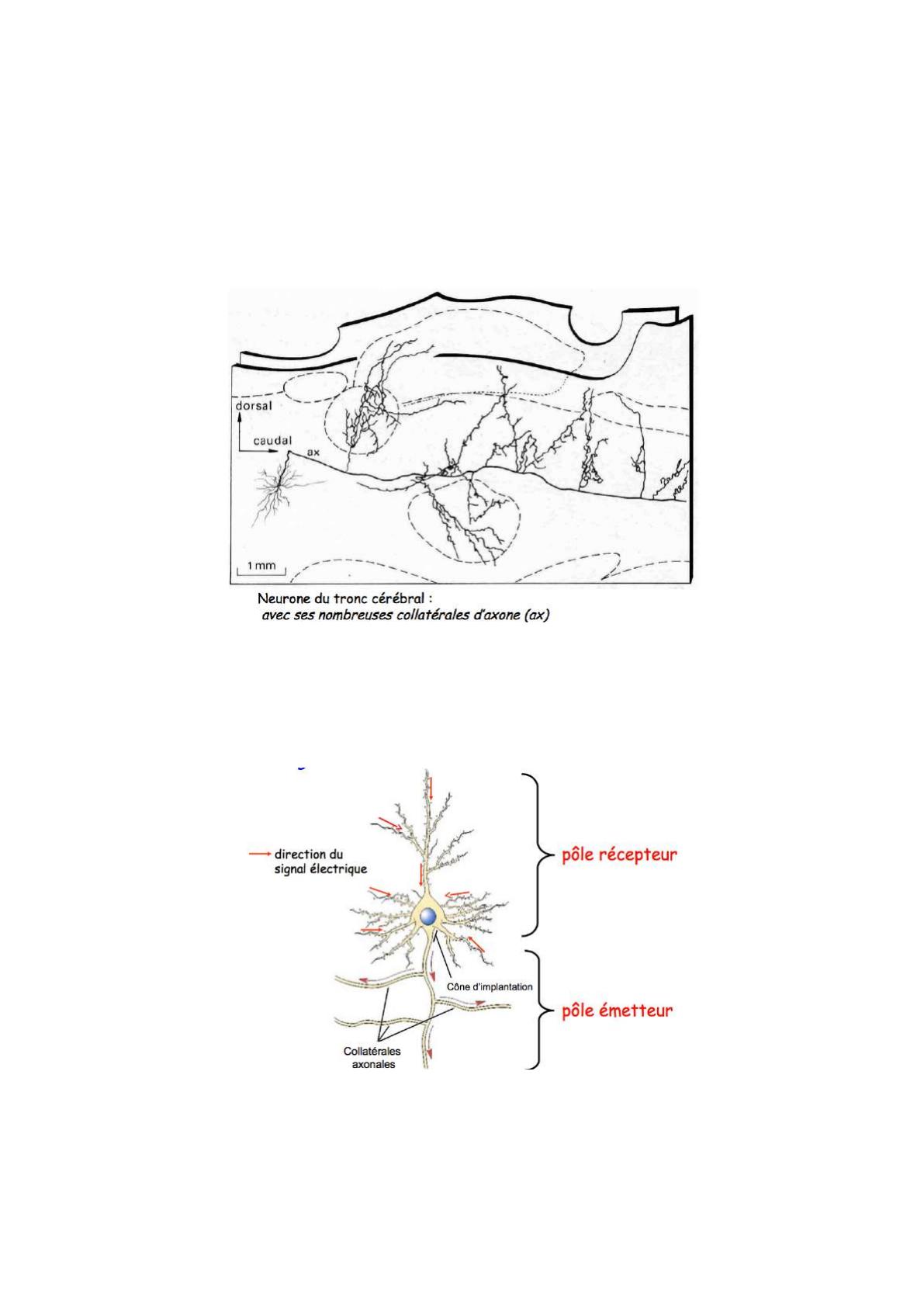
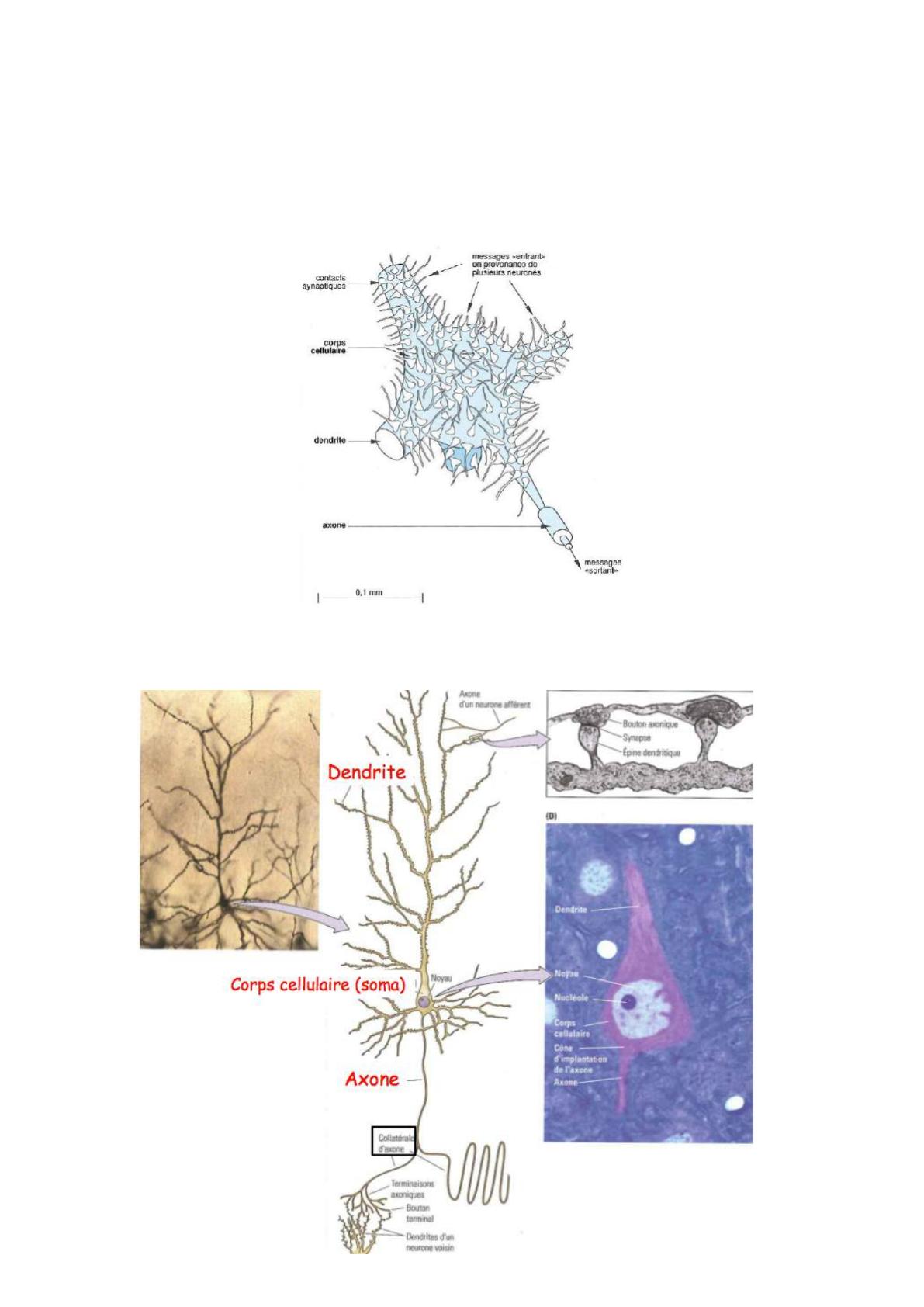
•Les neurones pyramidaux sont appelés ainsi car leur corps cellulaire sont en forme de
pyramide."
•Un neurone pyramidal du cortex possède des dendrites qui forment un arbre."
•En effectuant un grossissement d’un petit bout de dendrite, on observe des extensions:
ce sont des épines dendritiques sur lesquelles vont se faire les synapses."
•Ce neurone possède un unique axone qui peut envoyer des collatérales capables
d’établir des synapses."
•Un neurone ne peut avoir plus d’un axone. Par contre, l’axone peut posséder de
nombreuses collatérales."
!
➤ Régionalisation du traitement de l’information
•Le neurone est organisé de telle sorte qu'il y a une régionalisation de la fonction."
-L'arbre somato-dendritique est chargé de recevoir l'information et constitue ce qu'on
appelle le pôle récepteur. C’est au niveau des dendrites que naissent des signaux
électriques qu'on appelle les potentiels post-synaptiques:"
‣PPSE = Potentiel Post-Synaptique Excitateur"
‣PPSI = Potentiel Post-Synaptique Inhibiteur"
3
-Le corps cellulaire est en charge d’intégrer, de sommer tous ces signaux électriques."
-L'axone et les collatérales axonales constituent le pôle émetteur. Il émet un autre
type de signal électrique différent des potentiels post-synaptiques, c’est le potentiel
d’action. Le potentiel d’action est généré au niveau du segment initial.#"
!
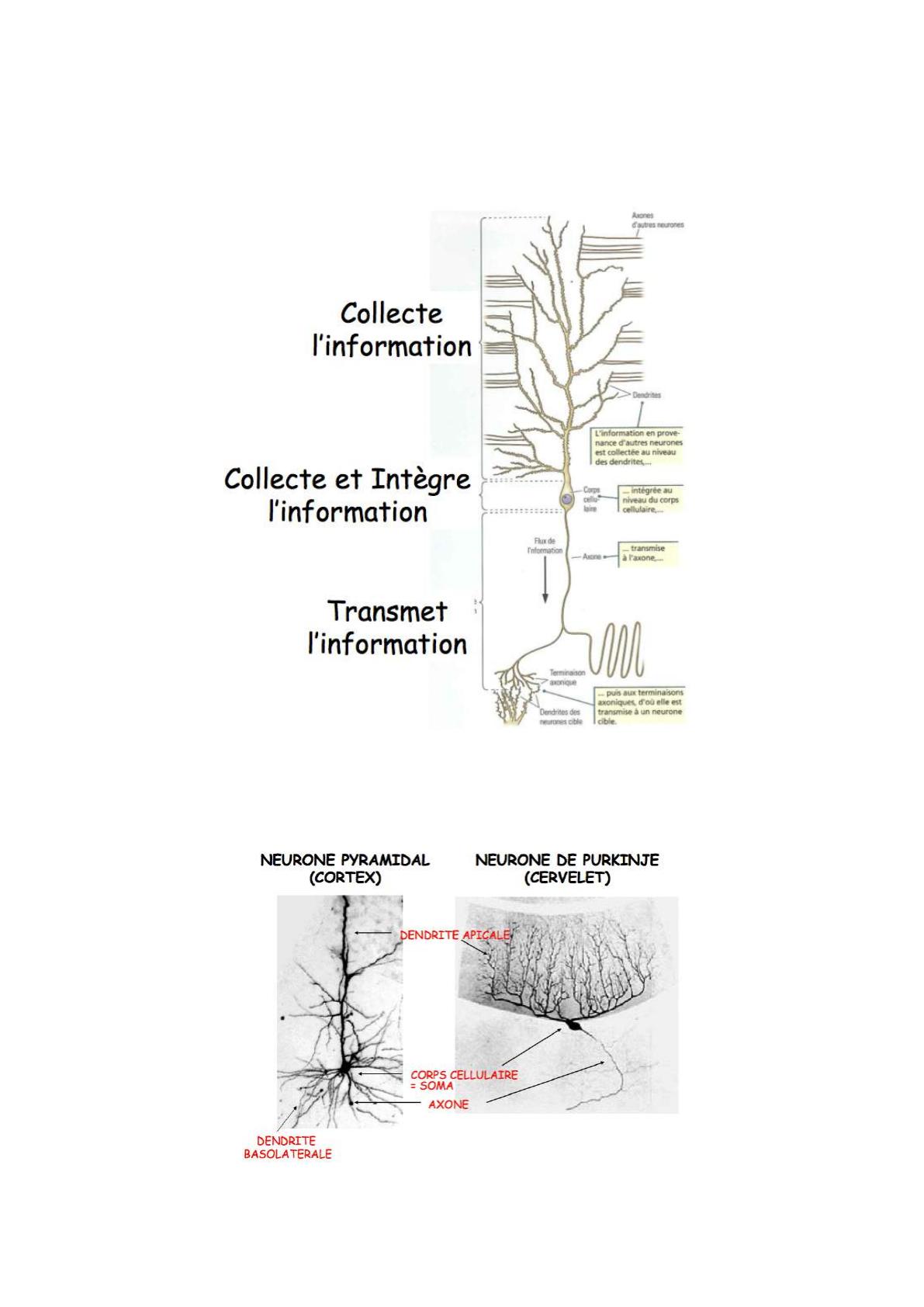
•Suivant les régions du système nerveux, les formes et l’arrangement dans l’espace des
neurones diffèrent:"
4
-Les neurones pyramidaux envoient des prolongements longs. On observe de fortes
arborisations dendritiques. On différencie la dendrite apicale des dendrites
basolatérales."
-Le neurone de Purkinje ne présente que des dendrites apicales."
!
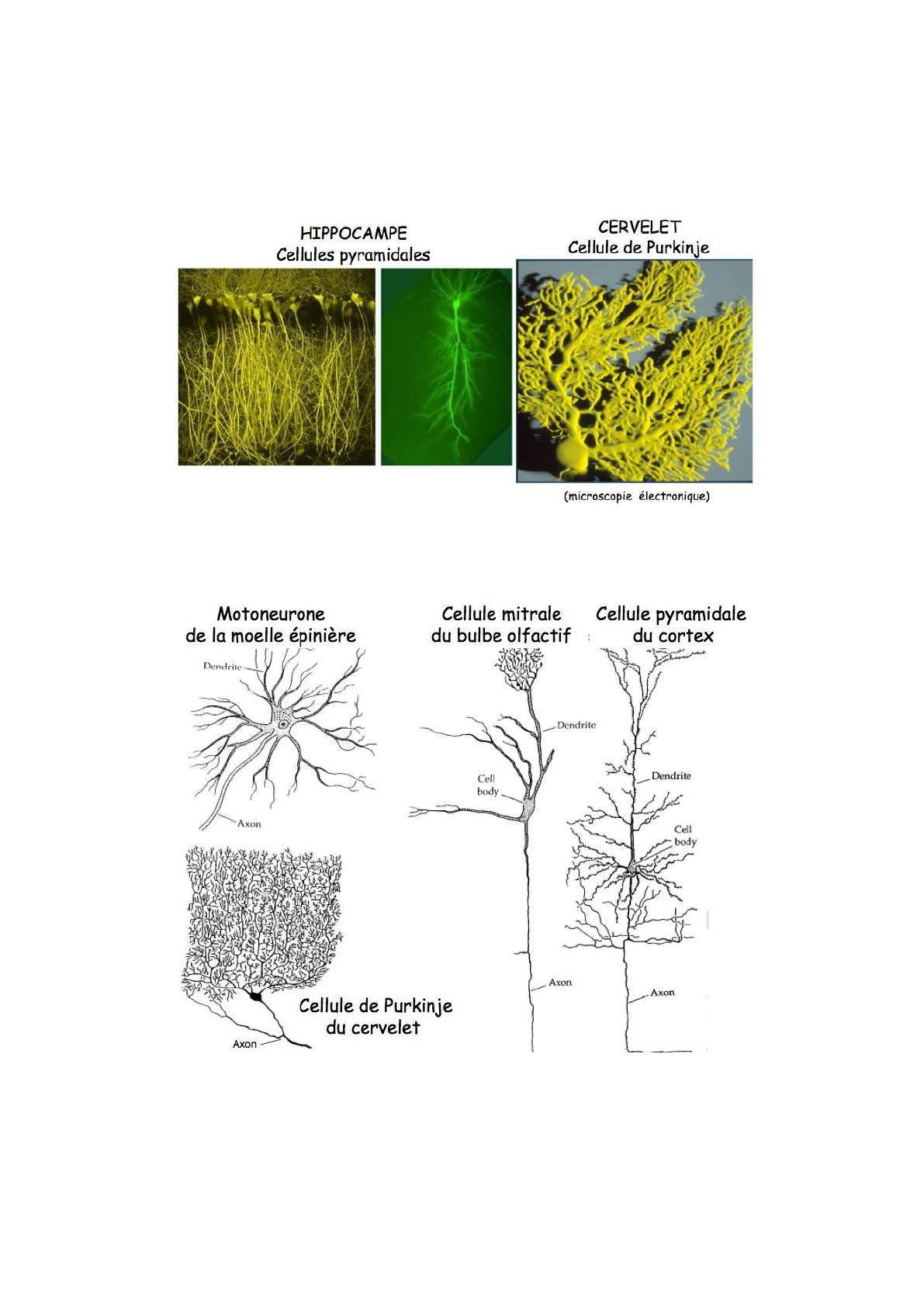
➤ Diversité structurale des neurones
•On peut voir des structures différentes selon les régions cérébrales."
!
➤ Développement du cerveau
•À la naissance,#les neurones n'ont pas fini leur développement."
5
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
1
/
68
100%