Analyse du risque infectieux lié aux échographies

080205_analyse_risque_infectieux_echographies_vf.doc InVS/DMI Page 1 de 26
Analyse
AnalyseAnalyse
Analyse du risque infectieux lié aux échographies endocavitaires
du risque infectieux lié aux échographies endocavitaires du risque infectieux lié aux échographies endocavitaires
du risque infectieux lié aux échographies endocavitaires,
, ,
,
en l’absence de protection ou de désinfection des sondes entre patients
en l’absence de protection ou de désinfection des sondes entre patientsen l’absence de protection ou de désinfection des sondes entre patients
en l’absence de protection ou de désinfection des sondes entre patients.
..
.
Composition du groupe
Composition du groupe Composition du groupe
Composition du groupe d’experts
d’expertsd’experts
d’experts
- D. Antona, P. Bernillon, B. Coignard, A. Gallay, C. Larsen, F. Lot
(InVS, Département Maladies Infectieuses, Saint-Maurice)
- Y. Yazdanpanah (CH Tourcoing)
- E. Bouvet (AP-HP Bichat - Claude Bernard, Paris)
- K. Blanckaert, A. Carbonne, Zoher Kadi (CClin Paris-Nord, Paris)
M
MM
Microbiologistes
icrobiologistesicrobiologistes
icrobiologistes
consultés
consultésconsultés
consultés
- B. de Barbeyrac, Centre national de référence (CNR) des Chlamydia, Bordeaux
- F. Barin, CNR du VIH, Tours
- C. Bébéar, pour Mycoplasmes, CHU, Bordeaux
- A. Bianchi, CNR Syphilis, Bondy
- P. Coursaget, pour HPV, Faculté de Pharmacie, Tours
- F. Dromer, CNR Mycologie & Antifongiques, Paris
- J. Le Goff, pour HSV, Hôpital Saint-Louis, Paris
- JM. Pawlotsky, S. Chevaliez, CNR des hépatites B et C, Créteil
- P. Sednaoui, CNR Gonocoque, Paris
Coordination et rédaction
Coordination et rédactionCoordination et rédaction
Coordination et rédaction
:
::
: B. Coignard
Relecture
RelectureRelecture
Relecture
:
::
: JC. Desenclos, Y. Yazdanpanah
Institut de V
Institut de VInstitut de V
Institut de Veille Sanitaire, Saint
eille Sanitaire, Sainteille Sanitaire, Saint
eille Sanitaire, Saint-
--
-Maurice
MauriceMaurice
Maurice
05/02
05/0205/02
05/02/2008
/2008/2008
/2008

080205_analyse_risque_infectieux_echographies_vf.doc InVS/DMI Page 2 de 26
Résumé
RésuméRésumé
Résumé
En décembre 2007, les inspections diligentées par deux Ddass dans cinq cabinets d’un centre d’imagerie
médicale suspectent des défauts d'hygiène concernant l’usage de sondes d'échographie endocavitaire
(endorectale ou endovaginale). L’Institut de veille sanitaire (InVS) est alors saisi d’une demande d’analyse des
risques infectieux liés à ces pratiques.
Le risque infectieux lié aux échographies endocavitaires réalisées sans biopsie, en l’absence de protection ou de
désinfection des sondes, est inconnu. Aucun cas d’infection lié à ce contexte n’est rapporté dans la littérature.
Une analyse systématique de ce risque a donc été conduite par un groupe d’experts multidisciplinaire
coordonné par l’InVS.
Cette analyse avait pour objectif d’identifier une liste d’agents infectieux à considérer en priorité pour informer
les patients exposés à ces actes, leur proposer un dépistage et si nécessaire une prise en charge. Les micro-
organismes étudiés sont ceux qui en cas de transmission sont responsables d’infections aiguës et chroniques,
parfois asymptomatiques. Les complications de ces infections peuvent être sévères, pour le patient ou le
nouveau-né dans le cas des femmes enceintes, et elles sont accessibles à une prise en charge.
Sur la base d’une revue des informations disponibles pour chaque micro-organisme, le risque individuel d’avoir
contracté une infection suite à des actes d’échographie est jugé extrêmement faible par le groupe d’experts.
Toutefois, compte tenu de la taille de la population exposée et sous l’hypothèse maximaliste que tous les actes
d’échographie du centre d’imagerie aient été réalisés sans protection ou désinfection des sondes, le fait qu’au
moins une infection ait pu survenir suite à ces actes doit être envisagé.
La décision d’informer les patients et de leur proposer un dépistage doit être prise après évaluation de sa
balance avantages-inconvénients, en tenant compte des risques infectieux potentiels lors de ces actes, qui sont
extrêmement faibles sur le plan individuel, et d’autres paramètres non pris en compte dans cette expertise (loi
du 4 mars 2002, stress et anxiété générés chez les patients, etc.)
Si cette décision est prise, la proposition de dépistage doit concerner cinq types d’infection, par ordre de risque
infectieux décroissant : hépatite B (chez les sujets non vaccinés ou si vaccinés, ceux pour lesquels la vérification
de l’immunité n’est pas satisfaisante), infection à
C. trachomatis
, infection à VIH, hépatite C et syphilis. Pour les
femmes actuellement enceintes, le dépistage d’une infection à VIH, d’une infection à VHB et de la syphilis doit
être proposé si possible avant l’accouchement. L’existence d’une prise en charge bien codifiée et systématique
des femmes enceintes permet par contre d’éliminer les risques liés à l’herpès et au streptocoque B.
Compte tenu de leur prévalence dans la population générale et de leurs modes de transmission habituels, la
découverte éventuelle d’une de ces infections ne permettra en rien d’affirmer qu’elle est liée à l’acte
d’échographie réalisé.
Si une information des patients et une proposition de dépistage est décidée, une évaluation de ce programme
doit être discutée afin de fournir un descriptif de sa réalisation au sein de la population ciblée.

080205_analyse_risque_infectieux_echographies_vf.doc InVS/DMI Page 3 de 26
Table des
Table desTable des
Table des matières
matières matières
matières
1
Contexte........................................................................................................................................................4
2
Objectifs du travail et limites ........................................................................................................................4
3
Méthodes......................................................................................................................................................5
4
Résultats .......................................................................................................................................................6
4.1
Données disponibles pour chaque micro-organisme étudié ................................................................6
4.1.1
Virus de l’immunodéficience humaine (VIH)..................................................................................6
4.1.2
Virus de l’hépatite B (VHB) ............................................................................................................7
4.1.3
Virus de l’hépatite C (VHC)............................................................................................................8
4.1.4
Papillomavirus humains (HPV).......................................................................................................9
4.1.5
Virus de l’herpès (HSV) de type 1 ou 2...........................................................................................9
4.1.6
Chlamydia trachomatis................................................................................................................10
4.1.7
Treponema pallidum (syphilis).....................................................................................................11
4.1.8
Neisseria gonorrhoeæ (gonococcie) ............................................................................................12
4.1.9
Trichomonas vaginalis .................................................................................................................13
4.1.10
Cytomégalovirus (CMV)...............................................................................................................13
4.2
Analyse du risque infectieux..............................................................................................................14
4.2.1
Exclusion de micro-organismes d’après leurs caractéristiques épidémiologiques ou cliniques ....14
4.2.2
Analyse qualitative du risque infectieux ......................................................................................14
4.2.3
Probabilité de trouver au moins une personne infectée dans une cohorte de taille N .................16
4.2.3.1
Résultats pour le VIH ...........................................................................................................17
4.2.3.2
Résultats pour le VHB..........................................................................................................18
4.2.3.3
Résultats pour le VHC..........................................................................................................18
4.2.4
Autres facteurs à prendre en compte dans le choix du dépistage à proposer..............................19
4.2.4.1
Impact clinique de l’infection...............................................................................................19
4.2.4.2
Cas particulier des femmes enceintes et des nouveau-nés ..................................................20
4.2.4.3
Faisabilité et coût du dépistage...........................................................................................21
4.2.4.4
Estimation de l’imputabilité des infections à l’acte d’échographie ......................................21
5
Discussion ...................................................................................................................................................22
6
Conclusion et recommandations.................................................................................................................24
7
Références...................................................................................................................................................25

080205_analyse_risque_infectieux_echographies_vf.doc InVS/DMI Page 4 de 26
1
11
1 Contexte
ContexteContexte
Contexte
En décembre 2007, un centre d’imagerie regroupant 5 cabinets dans les départements du Nord et de l’Aisne fait
l'objet d'une enquête des autorités sanitaires et de l’assurance maladie suite à des doutes sur la qualité des
pratiques entourant des actes de mammographie et des soupçons de surfacturation. Les inspections alors
diligentées par les Ddass suspectent aussi des défauts d'hygiène concernant l’usage de sondes d'échographie
endocavitaire (endorectale ou endovaginale), dont la Ddass du Nord informe l’InVS le 12 décembre 2007.
Les rapports d’inspection préliminaires des Ddass font état de l'absence, dans certains cabinets, de gaines de
protection (ou de préservatifs) permettant de protéger les sondes d'échographie pendant l'examen et de
l'absence éventuelle de désinfection des sondes entre patients (pas de protocole disponible, pas de produits
désinfectants dans les locaux). A la date de rédaction de ce rapport, l’évaluation de l'ampleur de ces pratiques
(nombre de cabinets et de praticiens concernés, périodes considérées comme « à risque ») est en cours. Aucune
donnée sur d’éventuels patients ayant pu développer une infection après un acte d’échographie réalisé dans ce
centre n’est disponible. Cependant, certaines infections se caractérisent par leur caractère fréquemment
asymptomatique jusqu’à une phase avancée.
Les constatations des Ddass sont suffisantes pour solliciter de la part de l’InVS une analyse des risques
infectieux chez les patients exposés à ces actes d’échographie. Compte tenu des défauts de pratique suspectés
et de la nature des actes (contact d'un dispositif médical avec des muqueuses et sécrétions biologiques,
dispositif médical non protégé réutilisé sans traitement préalable entre deux patients), la transmission de
patient à patient d’une infection bactérienne, virale ou fongique est en effet possible. Le principe de cette
analyse est validé lors d’une réunion organisée par la Direction générale de la santé (DGS) le 20/12/2007.
Les publications rapportant des contaminations bactériennes ou virales lors d’actes d’échographie sont
extrêmement rares. Ainsi, seuls quatre cas groupés d’infection à
Pseudomonas aeruginosa
après biopsie
transrectale échoguidée ont été rapportés par les
Centers for Disease Control and Prevention
(Etats-Unis) en
2006 [1]. En l'absence d'autres cas rapportés dans la littérature de transmission de pathogènes (bactéries, virus
ou champignons) par des actes d‘échographie, l’InVS a conduit une analyse des risques infectieux liés à ces
actes. Cette analyse a été collégiale, systématique et basée sur les données disponibles. Multidisciplinaire, elle a
associé plusieurs experts infectiologues, microbiologistes, épidémiologistes et hygiénistes (liste en 1
ère
page).
2
22
2 Objectifs du travail
Objectifs du travailObjectifs du travail
Objectifs du travail et limites
et limites et limites
et limites
Cette analyse des risques infectieux est qualitative. Elle a pour but d’identifier une liste d’agents infectieux à
considérer en priorité pour informer les patients exposés à ces actes, leur proposer un dépistage et si nécessaire
une prise en charge.
Elle est réalisée avec pour postulat que tous les actes d’échographie du centre d’imagerie concerné ont été
réalisés sans protection ou désinfection des sondes. Par ailleurs, d’après les informations communiquées par les
Ddass, ces actes d’échographie ne s’accompagnaient d’aucun acte invasif (biopsie).
Les résultats et recommandations issus de ce travail devront être mis en regard de la réalité des pratiques du
centre, en cours d’évaluation par les autorités sanitaires. Enfin, dans la mesure où les risques considérés dans
cette analyse sont très faibles, la prise en compte de la taille de la population exposée est un élément clef quant
à la réalité du risque. Cet aspect a été intégré dans l’analyse à partir d’effectifs théoriques, en l’absence d’une
description précise de la population des patients exposés.

080205_analyse_risque_infectieux_echographies_vf.doc InVS/DMI Page 5 de 26
3
33
3 Méthodes
MéthodesMéthodes
Méthodes
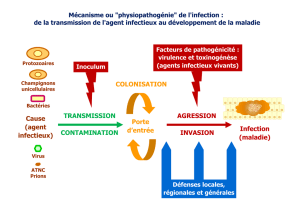
L’évaluation concerne les micro-organismes pathogènes (bactéries, virus, parasites ou champignons)
susceptibles d’être transmis par contact indirect, via les sondes, avec les sphères génitales ou digestives basses :
virus de l’hépatite B (VHB), de l’hépatite C (VHC), de l’immunodéficience humaine (VIH), Papillomavirus
humains (HPV), virus Herpes simplex (HSV),
Treponema pallidum
(syphilis), gonocoque,
Chlamydia trachomatis
,
Trichomonas vaginalis
et cytomégalovirus. Elle exclut les micro-organismes commensaux (mycoplasmes,
Candida
, streptocoque du groupe B
1
, etc.) de ces mêmes sphères.
Pour chaque micro-organisme, l’analyse du risque tient compte de plusieurs critères : la prévalence de
l’infection dans la population générale (quand elle est disponible), la durée de persistance du micro-organisme
sur une surface inerte (telle qu’une sonde d’échographie) et la probabilité de transmission de ce micro-
organisme suite à un contact avec une sonde contaminée. L’analyse tient aussi compte de la durée d'incubation
et de la proportion de formes asymptomatiques de l’infection, de son impact en termes de morbidité (caractère
aigu ou chronique de l’infection) ou de mortalité pour le patient, ses éventuels partenaires ou le nouveau-né
(chez les femmes enceintes). L’existence de mesures de gestion (dépistage, traitement, recommandations, etc.)
est enfin un élément déterminant de cette analyse.
Les critères retenus ont été recueillis pour chaque micro-organisme pathogène par une revue de la littérature
indexée dans Medline, l’interrogation des bases de données de surveillance de l’InVS, et la consultation de
plusieurs experts, notamment des microbiologistes pour estimer la durée de persistance de chaque micro-
organisme sur des surfaces inertes.
Ils ont ensuite été discutés lors de 2 réunions téléphoniques du groupe du travail (le 17/12/2007 et le
15/01/2008) puis par échange de courriers électroniques pour aboutir à cette synthèse.
La première partie de ce document (§ 4.1) présente un inventaire des données disponibles, avec les références
correspondantes, pour chaque micro-organisme. La seconde partie de ce document (§ 4.2) présente les résultats
de l’analyse des risques.
Sur cette base, les conclusions présentent à la DGS des recommandations de dépistage à proposer en priorité
aux personnes exposées à ces actes d’échographie. Ces recommandations ont été adoptées à l’unanimité ou à
la majorité des experts ; les avis minoritaires éventuels sont mentionnés dans le texte.
1
Chez la femme enceinte, le streptocoque du groupe B fait l’objet d’une recommandation de dépistage systématique en
fin de grossesse. L’antibioprophylaxie en intra-partum permet alors de prévenir une transmission de la mère à l’enfant.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
1
/
26
100%