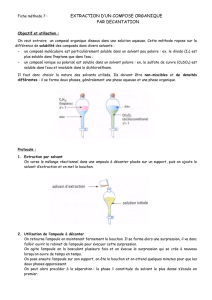
Préparation TP : Coefficient de partage en chimie organique

Préparation TP coefficient de partage
Lors de manipulations de synthèse de molécules en chimie organique, il n'est pas rare que le composé
désiré (C) soit obtenu en solution dans un solvant (S1). Il est alors nécessaire d'éliminer ce solvant pour
récupérer le produit C. Pour cela, on choisit de faire passer le composé C dans un autre solvant (S2).
(S2) est souvent un solvant organique, de faible température d'ébullition, et non miscible au solvant (S1).
On dit alors que l'on effectue l'extraction du produit C par le solvant (S2).
L’acide benzoïque C6H5COOH est très peu soluble dans l’eau mais assez soluble dans d’autres solvants
moins polaires que l’eau comme l’éther diéthylique (ou oxyde de diéthyle) ou le dichlorométhane.
On souhaite dans le TP réaliser l’extraction d’une solution aqueuse d’acide benzoïque par un solvant
organique non miscible à l’eau, l’huile de tournesol puis déterminer le coefficient (K) de partage de
l’acide benzoïque entre l’eau et l’huile de tournesol.
Travail demandé :
Vous étudierez attentivement les documents fournis dans la préparation, qu’il s’agisse des documents
papier ou vidéo et répondrez aux différentes questions posées. La préparation sera jointe au TP.
I) De l’utilité d’une extraction :
Le document 1 présenté en annexe, est un extrait de protocole de TP dont le but est de mesurer la masse
de nicotine contenue dans une cigarette. Dans cet extrait, n’est présentée que la partie expérimentale
correspondant à l’extraction de la nicotine du tabac.
Après lecture de cette annexe, répondre aux questions suivantes :
a) Avez-vous déjà utilisé la technique d’extraction par un solvant dans votre scolarité ? Si oui à quelle
occasion ?
b) Quel est l’intérêt d’une extraction par un solvant ?
c) Dans l’ampoule à décanter, la phase organique (éther) est-elle dans la partie supérieure ou inférieure ?
Justifiez avec les données de l’énoncé.
d) Pourquoi le protocole ne suggère-t-il pas une seule extraction avec 20 mL d’éther mais deux
extractions avec 10 mL chacune ?

II) Choix du solvant :
Pour pratiquer une extraction dans le but d’isoler l’acide benzoïque, on peut utiliser des solvants tels que
le dichlorométhane CH2Cl2, ou le diéthyloxyde Et-O-Et.
En considérant les documents fournis en annexe, justifier le choix du solvant « huile de tournesol ».
III) Coefficient de partage :
Définition : Un composé C est initialement dans un volume Vaq d'eau (S1). On le met en présence d'un
volume Vorg de solvant organique (S2). Une partie de C contenu dans l'eau passe dans la phase
organique, lors de l’établissement de l’équilibre suivant :
Caq$ $Corg$$$$$$$$$$$$
K=[Corg ]
[Caq ]
$
K correspond à la constante de l'équilibre de passage de C de l'eau vers le solvant organique.
K est le coefficient de partage et ne dépend que de la température (pour un composé C fixé). On désire
mesurer dans le TP le coefficient de partage de l'acide benzoïque (C) entre l'eau et l’huile de tournesol.
IV) Dosage colorimétrique d’un acide par une base forte, la soude :
https://www.youtube.com/watch?v=heKCNupkgM0
Revoyez grâce à cette vidéo, le principe du titrage colorimétrique d’un acide par le soude ; prenez des
notes pour les différentes étapes à respecter au cours du dosage ; vous aurez à reproduire ces étapes
mardi au cours du TP.
ANNEXE :
Document 1 : « Extrait d’un protocole de TP »
EXTRACTION*DE*LA*NICOTINE*DES*FEUILLES*DE*TABAC*
Nous allons extraire la nicotine des feuilles de tabac séché (tabac à rouler ou cigarettes) où nous la
trouvons dans une proportion de 2 à 8% en masse, combinée à de nombreux composés (jusqu’à 4000
composés).
1)#Préparation#préalable#–#«#jus#basique#»$
Prélever$le$tabac$de$6$cigarettes.$Peser.$$Placer$le$tabac$dans$un$bécher$de$400mL$contenant$50mL$
d’une$solution$de$soude$à$5%$en$masse.$Agiter$avec$un$agitateur$en$verre$pendant$5$minutes.$
$
Filtrer$sous$vide$à$l’aide$d’un$büchner$sans$utiliser$$

de$papier$filtre.$
$
Presser$le$tabac$lessivé.$$
Laver le tabac avec 10 mL d’eau distillée puis presser
à nouveau le résidu. Le jeter à la poubelle.
Récupérer le contenu de la fiole à vide dans un bécher en filtrant à l’aide d’une passoire fine afin
d’éliminer tout résidu solide éventuel.
2)#Extraction#de#la#nicotine#par#un#solvant#
#
Le$solvant$utilisé$est$l’éther$(oxyde$de$diéthyle$ou$éther$éthylique).$
$
$
θébu$(°C)$
densité$
Solubilité$de$la$nicotine$
Ether$
éthylique$
34,6$
0,71$
Très$soluble$
$
$
$
$
$
$
$
$
$
$
$
Procéder$ à$ une$ nouvelle$ extraction$ de$ la$ nicotine$ de$ la$ phase$ aqueuse$ à$ l’éther.$ Regrouper$ les$
phases$organiques$dans$un$erlenmeyer,$boucher.$
#
3)#Elimination#du#solvant#d’extraction#
Afin de récupérer la nicotine (huile), il faut éliminer le solvant. Pour cela on utilise un évaporateur
rotatif.
Regrouper les phases organiques de deux paillasses. Mettre en route l’évaporateur rotatif sous le
contrôle du professeur.
(temps d’attente pour l’évaporation du solvant : une dizaine de minutes - commencer la rédaction du
compte-rendu ).
Document 2 : caractéristiques de différents solvants organiques
1) Données physiques et toxicologiques sur le diéthyloxyde :
Procéder à une première extraction en versant
10mL d’éther dans l’ampoule à décanter puis le
filtrat précédent.
Agiter l’ampoule en prenant soin de bien dégazer.
Attention, l’éther est un solvant très volatil ! ! !
Laisser$décanter.$$
Recueillir la phase organique et la phase aqueuse
dans deux récipients adéquats.
$$

2) Données physiques et toxicologiques sur le dichlorométhane :
3) d’autres solvants existent :

Caractéristiques de l’huile de tournesol : flore99.free.fr/tounesol.doc
a) Caractéristiques chimiques :
- L’huile de tournesol est un mélange composé à 95% de triglycérides(formule CxHyOz) et de 5%
d’acides gras libres, de stérols, de cires, de diverses impuretés.
- Il n’y a pas de polluants dangereux comme le benzène, le plomb, ni aucun métaux lourds.
b) Caractéristiques physiques :
Densité à 20°C 0,92
Viscosité (CST) à 20°C 55-61
Point de fusion -16° ##
#
Il$ s’agit$ d’un$ corps$ stable$ très$ peu$ dangereux$ $ et$ peu$ polluant$ qui$ comporte$ $ peu$ de$ risques$
d’inflammation,$et$un$indice$d’évaporation$quasiment$nul.
1
/
5
100%