05/11/2015 ANTOINE Amélie L2 CR : Orianne DODIER

TSSI – Dynamique de la réponse innée
05/11/2015
ANTOINE Amélie L2
CR : Orianne DODIER
TSSI
Professeur VELY Frédéric
18 pages
Dynamique de la réponse innée
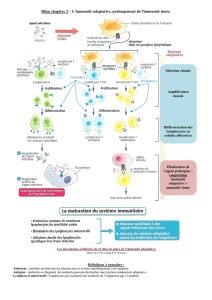
A. Introduction
I. Évolution d'une infection en fonction de la présence du système immunitaire.
Pour le système immunitaire il y a deux éléments importants: reconnaître le soi du non soi (notion de danger) et
diviser la réponse immunitaire en réponse immunitaire innée et réponse immunitaire adaptative.
Dans l'immunité innée, le terme «innée» veut dire que dès les premières heures de l'infection, il faut être
capable de lutter contre des agents infectieux. Pour faire ceci, il faudra avoir soit des molécules déjà « prêtes à
l'emploi », soit des cellules capables de réagir dans les premières minutes, les premières heures de l'infection. Si
on veut agir tout de suite il faut donc avoir des structures de reconnaissance qui sont déjà présentes et efficaces
et qui permettent de reconnaître un maximum d'agents pathogènes. C'est la propriété de l'immunité innée.
A l'inverse, l'immunité adaptative que l'on ne retrouve que chez les vertébrés, a évolué pour donner une
réponse de plus en plus spécifique. Son but n'est pas de ne pas reconnaître énormément de choses, mais plutôt
une seule: une immunoglobuline ne reconnaît qu'un déterminant antigénique ou « épitope », et le récepteur pour
l'antigène ne reconnaît qu'un complexe CMH-peptide. On a créé des diversités de reconnaissance avec un
répertoire très important.
Ces deux systèmes vont collaborer dans le temps au cours d'une infection.
1/18
Plan
A. Introduction
I. Évolution d'une infection en fonction de la présence du système immunitaire
II. Différences entre immunité innée et immunité adaptative
III. Les barrières naturelles
B. Dynamique de la réponse immunitaire
I. Mécanismes généraux
II. Reconnaissance des PAMP
III. Sécrétion de molécules inflammatoires
IV. Le système du complément
V. Mécanismes lors d'une infection virale
C. Conclusion

TSSI – Dynamique de la réponse innée
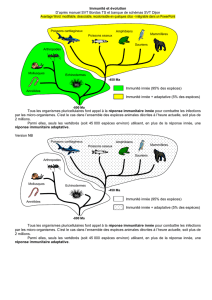
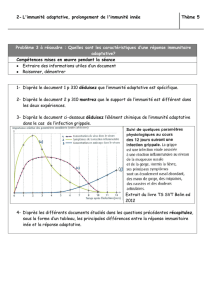
Dans les phases précoces de l'infection, chez un sujet sain (CR : en jaune), il y a une croissance au cours du
temps du nombre de micro-organismes qui l'infectent. Le rôle de l'immunité innée est soit d'éradiquer la
croissance de ce pathogène, soit d'en réduire grandement le nombre en attendant que l'immunité adaptative
arrive pour supprimer totalement l'agent pathogène de l'organisme.
Certains individus n'ont pas d'immunité innée fonctionnelle (CR : en rouge). Bien qu'ils aient une immunité
adaptative très performante, le nombre de micro-organismes va pouvoir flamber les premières heures ou
premiers jours de l'infection. À ce moment là, l'immunité adaptative est complètement débordée et n'arrive pas
à supprimer les agents pathogènes.
A l'inverse, on peut imaginer que l'immunité innée est fonctionnelle et que l'immunité adaptative ne l'est pas
(CR : en vert). A elle seule, l'immunité innée ne réussit pas à éradiquer complètement l'agent pathogène, elle
attend la cavalerie qui ne vient jamais. Petit à petit, l'infection « reflambe ».
II. Différences entre immunité innée et immunité adaptative.
Comment caractériser immunité innée et immunité adaptative ?
2/18

TSSI – Dynamique de la réponse innée
•Spécificité venant du génome ?
Pour l'immunité innée, la spécificité vient de notre génome. Il y a des gènes déjà structurés, arrangés, pour
donner une protéine qui sera un récepteur fonctionnel.
Pour l'immunité adaptative c'est très différent. On n'a pas dans notre génome, pour l'immunité adaptative, des
gènes qui codent pour des récepteurs. On a des segments géniques qui seront réarrangés de manière aléatoire
pour créer une diversité de répertoire pour le lymphocyte B et pour le lymphocyte T.
Il y a une grosse différence.
•Expression du récepteur par toutes les cellules d'un type particulier ?
Pour l'immunité innée, tous ces récepteurs sont exprimés par toutes les cellules d'un type particulier. Des
macrophages, des polynucléaires, vont pouvoir exprimer à leur surface une grande partie des récepteurs
destinés à l'immunité innée.
Ce n'est pas le cas de l'immunité adaptative. Tous les TCR ne sont pas exprimés par un LT : il y a un seul type
de TCR par lymphocyte T, un seul type d'immunoglobuline de surface par LB.
•Déclenchement d'une réponse immédiate ?
L'immunité innée doit déclencher une réponse immédiate pour être efficace les premières heures, premiers
jours de l'infection. C'est la caractéristique de l'immunité innée.
L'immunité adaptative se met en place en au moins 5 jours le plus souvent, pour avoir le temps d'avoir une
réponse avec des anticorps, et une coopération avec les LT (qu'ils soient auxiliaires ou cytotoxiques).
•Reconnaissance d'un spectre très large de pathogènes ?
Les récepteurs de l'immunité innée reconnaissent de grandes classes de molécules présentes à la surface de
nombreux pathogènes. Ces cellules reconnaissent des lipopolysaccharides, des dérivés de peptidoglycanes, de
la flagelline, qui vont être des déterminants présents dans de nombreux agents pathogènes.
Ce n'est pas le cas pour l'immunité adaptative. L'immunoglobuline de surface d'un LB va reconnaître un petit
épitope, qui est une petite séquence d'acides aminés, présent à la surface d'un agent pathogène. Le LT via son
TCR va reconnaître également un complexe peptidique associé à une molécule d'histocompatibilité. La
spécificité c'est : je reconnais un tout petit peptide que je ne dois retrouver à priori que dans un seul agent
pathogène.
•Distribution clonale ?
Dans l'immunité innée, on peut avoir plusieurs récepteurs de différentes spécificités sur la même cellule.
Dans l'immunité adaptative, un récepteur correspond à un clone de cellules.
•Capacité à différencier les agents pathogènes ?
Dans l'immunité innée, on reconnaît des structures qui sont présentes sur de nombreux pathogènes. On n'est
donc pas capable de dire si le lipopolysaccharide (LPS) provient d'une bactérie E. Coli ou Salmonella Typhi.
Dans l'immunité adaptative, un récepteur reconnaît un petit morceau d'E. Coli par exemple, et ne reconnaîtra
rien d'autre, même pas un autre morceau d' E. Coli.
3/18

TSSI – Dynamique de la réponse innée
III. Les barrières naturelles.
1) Barrières mécaniques.
Les bactéries doivent souvent pénétrer des épithéliums pour entrer dans l'organisme. Ces épithéliums ont la
caractéristique d'être faits de cellules très jointives avec des jonctions serrées qui ne sont pas facilement
franchissables. C'est déjà une première barrière.
Il y a un flux d'air ou de liquide à la surface des cellules épithéliales. Au niveau digestif ou bronchique des
mucus sont produits pour constituer des barrières, pour empêcher justement les bactéries de s'accrocher à ces
cellules épithéliales.
Il y a aussi des cellules ciliées avec un péristaltisme, et un déplacement du mucus par des cils vibratiles.
Tout ceci tend à éliminer les microbes par le flux.
2) Barrières chimiques.
Les barrières chimiques sont les acides gras cutanés, les enzymes (lysozyme dans la salive, la sueur, les
larmes), le pH (bas au niveau de l'estomac), les peptides anti-bactériens qui vont être sécrétés. On a déjà un
environnement un peu hostile pour des bactéries qui voudraient venir stimuler les entérocytes pour s'y
accrocher et pénétrer à l'intérieur.
3) Barrières microbiologiques.
On a une flore commensale, comme la flore intestinale, indispensable, qui permet de digérer les aliments et
qui protège de l'invasion par d'autres bactéries. La flore normale est en compétition avec les pathogènes pour
les nutriments et pour l’attachement à l’épithélium et peut produire des substances antimicrobiennes. Quand on
fait un traitement antibiotique par voie orale, on propose parfois de l'ultra-levure qui est un ferment lactique,
des bactéries qui vont recoloniser le tube digestif. Il y a une compétition qui empêche la fixation d'autres
bactéries qui pourraient être pathogènes.
B. Dynamique de la réponse immunitaire
I. Mécanismes généraux.
Il y a un passage suite à une blessure de la peau, et il y a déjà des cellules de l'immunité innée qui sont
présentes dans les tissus. Les principales sont les macrophages et les polynucléaires, qui sont déjà pourvus de
récepteurs capables de reconnaître ces agents pathogènes. Ils pourront faire de la phagocytose simple, ou de la
phagocytose médiée par des récepteurs. On commence déjà à dégrader certains agents pathogènes. Les
polynucléaires peuvent faire de la bactéricidie. Il y a aussi des cellules qui sont à l'interface entre immunité
innée et immunité adaptative, ce sont les cellules dendritiques.
4/18

TSSI – Dynamique de la réponse innée
Les cellules dendritiques sont immatures dans les tissus. A l'état immature elles phagocytent beaucoup pour
récupérer les agents pathogènes présents au niveau de la lésion. Leur rôle est de maturer par un voyage dans le
système lymphatique, jusqu'au ganglion le plus proche, où elles exprimeront beaucoup de molécules HLA.
Elles sont chargées de peptides dérivant du site de l'infection et elles vont les présenter à des lymphocytes dans
le ganglion. Quand elles ont trouvé le bon LT avec le bon TCR, qu'il est activé, les anticorps et les LT effecteurs
(ce ne sont plus des LT naïfs car il ont reconnu l'antigène au niveau des organes lymphoïdes secondaires)
retournent aider l'immunité innée.
Comment aident-ils l'immunité innée ?
Il y a des LT auxiliaires dont le rôle est de sécréter des cytokines. Il y a des anticorps dont le rôle est de
reconnaître des agents pathogènes. Quand tout ceci revient sur le site de l'infection, les anticorps se fixent sur
les bactéries et des complexes antigène-anticorps sont formés.
Il y a deux éléments :
–Un complexe antigène-anticorps active le complément. Le complément appartient à l'immunité innée, il
va pouvoir se fixer et entraîner la dégradation des bactéries recouvertes d'anticorps.
–Les macrophages sont pourvus de récepteurs pour les fragments du complément, de récepteurs pour le
fragment Fc des immunoglobulines, et vont réaliser une phagocytose facilitée, médiée par des
récepteurs. C'est beaucoup plus efficace.
Ça booste donc l'activité de l'immunité innée. Les LT auxiliaires arrivent sur le site de l'infection et sécrètent
des cytokines qui boostent l'activité des phagocytes.
Exemple chez l'homme : les infections à mycobactéries. La tuberculose par exemple vient d'une mycobactérie
particulière, mais on est soumis dans notre environnement à des mycobactéries anodines que nous éliminons
tous sans aucune difficulté.
Les mycobactéries sont prises en charge par des macrophages qui les digèrent. Le macrophage reçoit un signal
d'activation 1 : j'ai phagocyté, je suis activé. Sauf que pour les mycobactéries, ce signal d'activation 1 ne suffit
pas pour leur élimination. Un macrophage activé sécrète des cytokines, dont l'interleukine-12 qui va activer
les LT et les cellules NK. Les cellules activées par ce signal IL-12 produisent l'interféron γ.
L'IFN-γ est la cytokine qui active le mieux les macrophages : signal 2.
L'association du signal 1 et du signal 2 entraîne l'élimination efficace des mycobactéries par les macrophages.
Il y a des familles qui font des infections très graves à des mycobactéries anodines. La révolution c'est que
maintenant on peut séquencer « à tout va ». On est capable d'obtenir un génome humain complet en quelques
jours.
Des chercheurs ont pu voir donc qu'une famille touchée par ces infections avait des mutations dans le gène du
récepteur à l'IFN-γ. Les macrophages produisaient de l'IL-12, les LT touchés produisaient de l'IFN-γ, mais il n'y
avait jamais de signal 2, car pas de récepteur à l'IFN-γ. Les patients faisaient ces infections graves qui pouvaient
aller jusqu'à des formes cérébrales, des granulomes, et pouvaient mourir de ces infections à mycobactéries
anodines.
5/18
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
1
/
18
100%