Equilibres du corps pur Fichier - moodle@insa

ÉQUILIBRES PHYSIQUES DU CORPS PUR.
page 1/4
CHANGEMENTS D'ÉTAT PHYSIQUES DU CORPS PUR.
I : Équilibres entre les phases du corps pur.
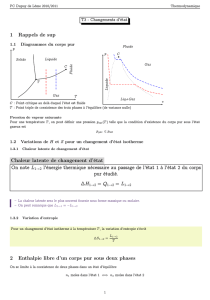
1°) Les changements de phase.
gaz
liquide
solide
entropie croissante
sublimation
condensation
vaporisation
liquéfaction
solidification
fusion
Par habitude, on réserve le mot vapeur à un corps
pur gazeux qui est liquide (ou solide) dans les condi-
tions habituelles de température et de pression ou qui
est très volatil.
On parle de gaz pour les autres corps qui sont ga-
zeux dans ces conditions habituelles.
2°) Condition d’équilibre de 2 phases ; stabilité d'une phase.
¾ On considère un corps pur sous deux phases (1) et (2) dans un
récipient maintenu à la température T et à pression P par
contact avec le milieu ambiant :
Il s’agit ici d’un système fermé, donc la quantité de matière
globale N = n1 + n2 reste constante.
n
1
moles
n
2
moles
Milieu ambiant
À T et P constantes
Phase 2
Phase 1
¾ Le potentiel thermodynamique approprié est l’enthalpie libre
totale G = n1.G1,m + n2.G2,m (conséquence de l’extensivité de
G), qui à T et P fixés doit être minimale à l’équilibre.
o Si 1, 2,m
GG≠m
, G est minimale quand tout le corps pur se retrouve dans la phase
d’enthalpie libre la plus faible :
il n’y a en ce cas qu’une seule phase stable
.
o Si 1, 2,m
GG=m
, les deux phases peuvent coexister en équilibre.
¾ L’enthalpie libre molaire d’un corps pur est fonction de T et P. Ainsi,
la condition
1, 2,m
GG=m
fixe implicitement la relation P(T) pour les deux phases en équilibre
.
On retient :
L'équilibre thermodynamique impose l'égalité de tous les paramètres intensifs
d'état dans les deux phases. La phase la plus stable à T et P données est celle pour
laquelle le potentiel chimique a la plus petite valeur.
3°) Variance du corps pur.
La règle des phases de Gibbs, appliquée à un corps pur conduit à : v = 3 - ϕ.
- Pour un système monophasé, P et T sont des paramètres indépendants.
- Pour un système biphasé, la pression d'équilibre, appelée aussi pression de vapeur satu-
rante (ou même parfois tension de vapeur !) est fonction de la température : Peq = f(T).
- Pour un système triphasé, P et T sont parfaitement définies et imposées: on dit qu'on est au
point triple du corps pur considéré.
Exemple : point triple de l’eau : TT = 273,16 K et PT = 611 Pa (
≈
6 mbar).

ÉQUILIBRES PHYSIQUES DU CORPS PUR.
page 2/4
II : Les diagrammes de phase du corps pur.
1°) Les différentes représentations.
Surface caractéristique du corps pur.
Chaque état du corps pur est représenté par un
point dans un espace à trois dimensions (P, V, T). La
surface qu'il décrit est la
surface caractéristique
du corps pur. Cette surface délimite dans l'espace
plusieurs régions homogènes (monophasées), notées
solide, liquide et fluide.
D'autres régions, représentées par des surfaces
réglées, engendrées par des droites parallèles à l'axe
des V, correspondent aux équilibres liquide-gaz (L +
G), liquide-solide (L + S) et solide-gaz (S + G).
Ces trois surfaces se raccordent sur une ligne ap-
pelée
ligne triple
le long de laquelle le corps pur
est en équilibre sous trois phases, à TP.
La projection de la surface caractéristique dans le
plan (P,T) donne les trois courbes de saturation:
sublimation, vaporisation et fusion, raccordées au
point triple, projection de la ligne triple dan le plan
(P, T).
La courbe de vaporisation va de T = TP (point triple) à T = Tc (point critique).
La projection dans le plan (P,V) des intersec-
tions de la surface caractéristique P(V,T) par les
plans T = Cste, forme un réseau d'isothermes,
appelées isothermes d'Andrews.
2°) L'équilibre liquide-vapeur.
Liquéfaction par compression isotherme.
On peut liquéfier un gaz par compression isotherme, à condi-
tion d'être à T < Tc , où
T
c
est la
température critique
. Pour T
< Tc, on distingue trois zones:
1. AtG: phase gazeuse seule (vapeur sèche).
En G apparaît la première goutte de liquide: on dit qu'on a
une vapeur saturante.
2. GtL: palier isobare appelé
palier de liquéfaction
corres-
pondant à l'équilibre liquide-gaz du corps pur.
En L disparaît la dernière bulle de gaz: on dit qu'on a du li-
quide saturant.
3. LtB: phase liquide.

ÉQUILIBRES PHYSIQUES DU CORPS PUR.
page 3/4
L'isotherme critique ne présente plus de palier, mais un
point d'inflexion
à
tangente horizontale
en coordonnées de Clapeyron
, au point critique C.
Exemple pour l’eau : T C = 374,2 °C et PC = 215 bar.
Courbe de saturation.
L'ensemble des extrémités GL des paliers forme la courbe de saturation,
constituée de la
courbe de rosée
(lieu des points G) et de la
courbe d'ébulli-
tion
(lieu des points L), ces deux courbes se rejoignant en C.
Point représentatif d'un équilibre liquide-gaz.
Un point M, d'abscisse v (v est le volume massique) situé sous la courbe de saturation, représen-
te l'état d'équilibre d'une masse unité m = 1 kg de corps pur, à la température T, telle que une
masse mA de liquide coexiste avec une masse mg de gaz.
On définit le titre massique en vapeur du mélange par xv = mv
mv + mA , cal-
culé à partir de la règle dite des "moments chimiques":
LG
LM
= (T)xv
MGmLMm g×=×
A, qui conduit à : .
Vous noterez que : sur la courbe d’ébullition (lieu des points L) : xv = 0,
et sur la courbe de rosée (lieu des points G) : xv = 1.
3°) Cas particulier de l'eau.
Pour la plupart des corps on a : ρliq < ρsol. Conséquence : la courbe de fusion d'un corps pur a
une pente positive. Pour l'eau, (ainsi que pour Bi, Ga, Sb, Si, Ge) , la courbe de fusion présente
une pente négative (anomalie due au fait que μliq > μsol):

ÉQUILIBRES PHYSIQUES DU CORPS PUR.
page 4/4
III : Étude énergétique.
1°) Chaleurs latentes de changement d’état.
La
chaleur latente massique (ou molaire)
de changement de phase 1 → 2
d'un corps pur à la température T, notée Lm(T) est la
variation d'enthalpie
massique (ou molaire)
de ce corps lors du changement de phase 1 →2, à la
température T : 12
21
h - h = )(TLm
→.
Lien avec l'entropie : )s - T.(s = )( 12
21
TLm
→ (c’est une conséquence de l’égalité des enthalpies
libres molaires de chacune des phases à l’équilibre).
2°) Formule de Clapeyron.
En notant v1 et v2 les volumes massiques du corps sous les phases 1 et 2, la
chaleur latente massique de changement de phase est liée à la pente de la courbe
d'équilibre P(T), par la relation, appelée formule de Clapeyron:
()
eq
dT
dP
TL ⎟
⎠
⎞
⎜
⎝
⎛
→12
21 v- vT = )( .
Remarques :
¾ On peut utiliser les
grandeurs massiques
à la place des grandeurs molaires.
¾ La formule de Clapeyron est de
portée très générale
puisqu’elle est obtenue sans aucune
approximation à partir des seuls principes de la thermodynamique.
¾ La formule de Clapeyron donne une forme indéterminée du type dP/dT = 0/0 ( !) pour les
transitions de phases telles que s1 = s2 et v1 = v2. De telles transitions sont dites
transitions
de phase du 2ème ordre
(ou de deuxième espèce).
Pour de telles transitions, la chaleur
latente L est nulle
. Citons comme exemple, la transition liquide – gaz au point critique.
3°) Entropie d'un mélange liquide-vapeur.
Notons xv le taux de vapeur saturante (ou titre en vapeur) d'un mélange liquide-vapeur.
Soit s0 l'entropie du liquide de saturation (x = 0) à une température T0 arbitraire.
Soit s(T,x) l’entropie massique du mélange liquide-vapeur, de titre en vapeur x, à la température T:
sTx dT
TxLT
T
v
(,) . ()
= s c
0liq
'
T
T
0
++
∫.
où c’liq est la capacité thermique du corps pur quand on se déplace sur la courbe d’ébullition.
Remarque :
Si l’on est
loin du point critique
, on peut souvent considérer que c’liq est une constante (indé-
pendante de T) ; on obtient ainsi : T
TL
xTcxTs v
liq
)(
.)ln(C = ),( ,ste ++ .
1
/
4
100%