Carbonyles - Département de chimie

© Thierry Ollevier CHM-2000
Chimie organique II
RÉACTIVITÉ DU GROUPEMENT CARBONYLE
1. Réduction du groupement carbonyle
C O
δ+δ-
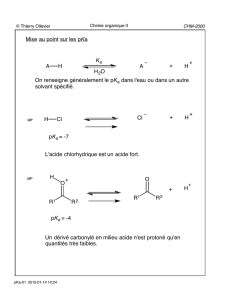
Caractère polaire de la fonction carbonyle :
C O C O
O
RR'
NaBH4
CH3CH2OHRR'
HOH
R ou R' peuvent être = H (aldéhydes)
O
RR'
1) LiAlH4
2) H2ORR'
HOH
(étape 2) = étape de parachèvement)
!
!
Ces réactions sont très utiles en synthèse. Ce sont des méthodes
de préparation courantes dans un laboratoire de chimie organique.
Elles seront dans la suite du cours représentées par le pictogramme !.
O
R H
O
RR'
O
ROR'
O
ROH
réduits par NaBH4
réduits par LiAlH4
carbonyles-01 2016-01-12 15:30

© Thierry Ollevier CHM-2000
Chimie organique II
Mécanisme de la réduction avec NaBH4
Mécanisme de la réduction avec LiAlH4
O
RR'
NaBH4
O
RR'
LiAlH4
Exemples
O
1) LiAlH4
2) H+, H2O
OH
O
NaBH4
HO H
HOH
50
50
carbonyles-02 2016-01-12 15:10

© Thierry Ollevier CHM-2000
Chimie organique II
RÉACTIVITÉ DU GROUPEMENT CARBONYLE
2. Oxydation des alcools
OH
RR'
O
RR'
!
K2Cr2O7
H2SO4, H2O
Problème avec les alcools primaires :
OH
R H
O
R H
K2Cr2O7
H2SO4, H2O
oxydation
plus
poussée
O
ROH
OH
R H
KMnO4
NaOH, H2O
O
ROH
O
R O
H+
3 CH3CH2OH +2 K2Cr2O7+8 H2SO43 CH3CO2H2 Cr2(SO4)3
2 K2SO411 H2O
+
++
OH
R H CrO3H2SO4 aq.
O
ROH
Cr3+
+++
carbonyles-03 2016-01-12 15:29

© Thierry Ollevier CHM-2000
Chimie organique II
Solution : oxydant en l'absence d'eau
NHCl CrO3
+ + N H CrO3Cl–
PCC
OH PCC
CH2Cl2
O
H
3. Addition des réactifs organométalliques
Br
Réactifs organolithiens
+2 Li Li +LiBr
X+2 Li +LiX
RLi
RI > RBr > RCl
Solvants généralement utilisés :
O
O
(THF)
R
carbonyles-04 2016-01-12 15:11

© Thierry Ollevier CHM-2000
Chimie organique II
Réactifs organomagnésiens (réactifs de Grignard)
R X +Mg R MgX
Et2O
Ar X +Mg Ar MgX
Et2O
Victor Grignard, Prix Nobel 1912
R MgX
O
+
ROH
!
Mécanisme
carbonyles-05 2016-01-12 15:11
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
1
/
20
100%