Couple acide-base : CORRECTION

Page 1
CORRECTION DES EXERCICES DU CHAPITRE n° 11
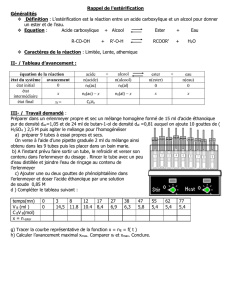
I) Hydrolyse d'un ester.
L'hydrolyse d'un ester A est la réaction inverse de l'estérification et peut s'écrire :
ester + eau
→
←
alcool + acide
A ou B sont donc l'acide ou l'alcool. On a, de plus, MH2O = 18 g.mol−1 et MCO2 = 44 g.mol−1.
a) i. Pour satisfaire à la loi de conservation de la matière, la réaction de combustion s'écrit :
CxHyOz + (
4
y
+x −
2
z
) O2
→
2
y
H2O + x CO2
La combustion complète de 1 mole de CxHyOz nécessite 6 moles de dioxygène et produit
90 g d'eau et 176 g de dioxyde de carbone.
D'où
4
y
+x −
2
z
= 6
2
y
=
18
90
= 5 x =
44
176
= 4
soit x = 4 y = 10 z = 1
La formule brute de B est donc C4H10O
D’où l’aquation-bilan : C4H10O + 6 O2
→
5 H2O + 4 CO2
ii. B ne contenant qu'un atome O ne peut être un acide carboxylique, c'est donc un alcool.
Une molécule est chirale si elle n'est pas superposable à son image dans un miroir.
Cette molécule possède donc un atome de carbone asymétrique, c’est-à-dire, un atome
de carbone entouré de 4 groupes tous différents. D'où la formule semi développée :
CH3 – CH2 – C*HOH – CH3 butan-2-ol
Où C* est le carbone asymétrique
iii. Le butan-2-ol est un alcool secondaire, son oxydation
ménagée conduit à une cétone :
La butanone de formule CH3 – CH2 – CO – CH3
Action de la butanone :
- le groupe carbonyle de la butanone agit avec la D.N.P.H. (2,4-dinitrophénylhydrazine) et
donne un précipité jaune de 2,4-dinitrophénylhydrazone.
On aurait la même réaction avec un aldéhyde ou un acide carboxylique qui contiennent
un groupe carbonyle.
- La butanone ne donne aucune réaction de réduction de l'argent sur une solution de
nitrate d'argent ammoniacal.
Contrairement à ce qu’on aurait avec un aldéhyde qui permet d’obtenir une argenture ou
un miroir d’argent.
Les deux réactions servent à distinguer une cétone d’un aldéhyde qui sont les produits de
l’oxydation ménagée, respectivement, d’un alcool secondaire et d’un alcool primaire.
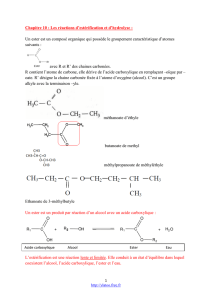
b) par "chloration" en présence de pentachlorure de phosphore (PCl5), on peut transformer le
corps C qui est donc un acide carboxylique en un chlorure d'acyle C'. L'action de C' sur la
méthylamine donne naissance au N-méthyléthanamide.
Le N-méthyléthanamide a pour formule CH3 – CO – NH – CH3
La méthylamine ayant pour formule NH2 – CH3
On en déduit la formule du chlorure d'acyle :
CH3 – CO – Cl qui est le chlorure d'éthanoyle
Obtenu à partir du corps C qui est :
l'acide éthanoïque : CH3 – CO – OH

Page 2
c) L'ester A qui donne le butan-2-ol (B) et l'acide éthanoïque (C) est donc
l'éthanoate de 1-méthylpropyle de formule :
d) Pour rendre l'estérification complète
L'utilisation d'un catalyseur accélère la réaction d'estérification mais ne modifie pas
l'équilibre !
, il faut
remplacer l'acide carboxylique par un chlorure d'acyle
(ici, le chlorure d'éthanoyle) ou à la rigueur par un anhydride d'acide (ici, l'anhydride
éthanoïque).
II) Rendement d’une réaction.
a) La réaction d’un acide carboxylique avec un alcool est une réaction d’estérification.
L’équation-bilan s’écrit : *
+
1
←
→
+
H
2
O
C’est une réaction lente, limitée et athermique qui conduit à un équilibre chimique. Pour
que la réaction s’effectue en un laps de temps raisonnable, il convient donc de chauffer le
mélange réactionnel et d’utiliser un catalyseur, ici, l’acide sulfurique. Ces deux facteurs
agissent sur la vitesse de formation de l’ester mais pas sur la limite de l’équilibre.
b) L’ester préparé est l’éthanoate de 1-méthylpropyle.
Cet ester existe sous forme de deux énantiomères car
il présente un atome de carbone asymétrique (repéré
par un astérisque).
La stéréoisomérie correspondante est l’énantiomérie.
c) Le rendement d’une réaction est le rapport entre la quantité de produit effectivement
obtenu et la quantité maximale à laquelle conduirait une réaction totale.
Ecrivons le bilan molaire de la réaction :
CH3COOH + C4H9OH
←
→
CH3COOC4H9 + H2O
à t = 0 : 0,2 0,2 0 0 mol.
à l’équilibre 0,08 0,08 0,12 0,12 mol.
La réaction a consommé : 0,2 − 0,08 = 0,12 mol d’acide éthanoïque qui a été converti en
ester. Si la réaction était totale, on obtiendrait 0,2 mol d’ester. Le rendement de la réaction
est donc : γ = 0,12/0,2 = 0,6 soit 60 %
d) La limite d’estérification lors de la réaction en quantité équimolaire d’un acide
carboxylique avec un alcool secondaire est précisément de 60 %. Cela signifie
qu’après 4 h de chauffage, l’équilibre est atteint.
i. Ayant déjà atteint l’équilibre, on n’améliore pas le rendement de la réaction en
poursuivant le chauffage.
ii. La température n’agit que sur la vitesse de réaction : en augmentant la température on
atteint plus vite l’équilibre. Un accroissement de la température ne déplace pas
l’équilibre d’estérification car la réaction est athermique.
iii. Un catalyseur n’agit que sur la vitesse de réaction : en augmentant la quantité de
catalyseur on atteint plus vite l’équilibre. Un catalyseur ne permet pas de déplacer un
équilibre car il agit de la même façon sur les deux réactions inverses.
e) D'après les lois de Le Chatelier :
- on peut augmenter la quantité d'un réactif (ici le moins coûteux est l'acide).
- on faire disparaître un des produit (par distillation s'il est le plus volatile).
- on peut remplacer l'acide par un chlorure d'acyle (on sait que la réaction est alors totale
- le coût de fabrication du chlorure peut être un handicape).
1
/
2
100%