PDF (Partie_2_sur_3 : Chapitre II)

49
Chapitre II
Confinement de nanoparticules métalliques à
l’intérieur de nanotubes de carbone

50

51
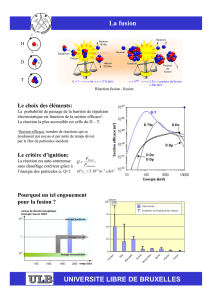
II CONFINEMENT DE NANOPARTICULES MÉTALLIQUES À
L’INTÉRIEUR DE NANOTUBES DE CARBONE
II.1 INTRODUCTION AUX MÉTHODES DE CONFINEMENT DANS LES
NANOTUBES DE CARBONE
Grâce à sa structure tubulaire creuse, le nanotube de carbone est considéré comme un
support idéal pour confiner d’autres composés ou éléments à l’intérieur de ses canaux [1-3].
Plusieurs méthodes de synthèse ont ainsi été étudiées, permettant de remplir les NTCs d’un
grand nombre d’éléments sous différentes formes telles que des molécules, des atomes isolés,
des particules ou des fils nanométriques [3]. La possibilité de remplissage des nanotubes par
différents types de composés (métaux, métaux magnétiques, semi-conducteurs,...) ouvre des
possibilités d’étude et d’application de nanotubes hybrides ayant éventuellement de nouvelles
propriétés, très différentes de celles des nanotubes de carbone vides [4,5].
a) b) c)
Figure 2.1 : Représentation de la structure tubulaire creuse de :
a) nanotube mono-paroi ; b) nanotube bi-parois et c) nanotube multi-parois.
Il y a deux voies principales permettant de remplir les nanotubes par un grand nombre
de composés: le remplissage in-situ (durant la synthèse des NTCs) ou ex-situ (post-synthèse).
II.1.1 Remplissage de NTCs in-situ
Pour cette méthode, le remplissage s’effectue en même temps que la synthèse des
nanotubes de carbone, principalement par la technique à arc électrique (prodédé à haute
température) ou par le processus de dépôt chimique en phase vapeur catalytique (C-CVD,

52
procédé à température modérée). Ces deux techniques conduisent en général à la synthèse et
au remplissage de nanotubes multi-parois.
II.1.1.1 Arc électrique
Le principe de cette technique consiste à appliquer entre deux électrodes de graphite une
différence de potentiel de l’ordre de la vingtaine de volts [6]. L’arc éléctrique qui se produit
entre les deux électrodes permet d’élever la température à plusieurs milliers de degrés,
entraînant une sublimation des éléments constituant l’anode au sein d’un plasma. Puis, ils se
recondensent sur la cathode et sur les parois du réacteur.
Figure 2.2 : Schéma de l’appareillage pour la sythèse par arc électrique de NTCs.
Pour la synthèse de SWNTCs, les électrodes doivent contenir quelques pour-cent d’un
métal catalytique. Par contre, cette technique a uniquement permis de remplir, mais en faible
quantité, des SWNTCs formés dans la toile ou la collerette avec du Bi [7] et avec des C60
(peapods) [8].
De fait, la technique à l’arc électrique reste essentiellement applicable au remplissage de
MWNTCs. En utilisant des electrodes en graphite pur, seuls des MWNTCs sont obtenus [6,9].
Ainsi, la synthèse de MWNTCs remplis peut s’effectuer en dopant l’anode avec l’élément à
confiner. Les MWNTCs se forment sur la cathode au sein d’un dépôt constitué de nombreux
sous produits de synthèse (nanoparticules métalliques, carbone amorphe,...). Une partie des
MWNTCs formés à la cathode est remplie de l’élément initialement utilisé pour doper
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
1
/
84
100%