ecole nationale veterinaire d`alfort - Thèses

ECOLE NATIONALE VETERINAIRE D’ALFORT
Année 2002.
APPROCHE CLINIQUE DES MASSES SURRENALES DE
DECOUVERTE FORTUITE CHEZ LES CARNIVORES
DOMESTIQUES : ETUDE BIBLIOGRAPHIQUE.
THESE
pour le
DOCTORAT VETERINAIRE
presentée et soutenue publiquement
devant
LA FACULTE DE MEDECINE DE CRETEIL
le
…………………..
par
Nathalie FAILLY
née le 26 Août 1977 à Noisy le Sec (93)
JURY
Président : M……………..
Professeur à la Faculté de Médecine de CRETEIL
Membres
Directeur : M. J-L POUCHELON
Professeur à l’E.N.V.A.
Assesseur : M. F. CRESPEAU
Professeur à l’E.N.V.A.
Invité : M. D. ROSENBERG.

TABLE DES MATIERES :
INTRODUCTION 5
PREMIERE PARTIE : PHYSIOLOGIE DES GLANDES SURRENALES ET
PATHOGENIE 7
1/ rappels de physiologie des surrénales 9
1-1/ la médullaire : sécrétion de catécholamines 9
1-2/ la zone glomérulée du cortex : sécrétion d’aldostérone 16
1-3/ les zones fasciculée et réticulée : sécrétion des glucocorticoïdes et de
stéroïdes sexuels 21
2/ nature des lésions touchant les surrénales et principaux symptômes 24
2-1/ étiologie des masses surrénales 24
2-2/ principaux symptômes rencontrés lors de dysendocrinie surrénale 26
DEUXIEME PARTIE : DECOUVERTE FORTUITE D’UNE MASSE
SURRENALE AU COURS D’UN EXAMEN D’IMAGERIE
ABDOMINALE : CARACTERISTIQUES DES IMAGES 31
1/ circonstances cliniques de découverte fortuite d’une masse surrénale 33
2/ techniques d’imagerie des surrénales : principes, intérêts, limites 33
2-1/ la radiographie abdominale 33
2-2/ l’échographie abdominale 34
2-3/ la tomodensitométrie 35
2-4/ l’imagerie par résonance magnétique 36
2-5/ la scintigraphie 39
3/ caractéristiques des images 40
3-1/ la radiographie abdominale 40
3-2/ l’échographie abdominale 41
3-3/ la tomodensitométrie 45
3-4/ l’imagerie par résonance magnétique 46
3-5/ la scintigraphie 47
1

TROISIEME PARTIE : CONDUITE A TENIR FACE A LA DECOUVERTE D’UN
FORTUITOME 49
1/ la masse est-elle bien surrénale ? 51
2/ la masse est-elle sécrétante ? 51
2-1/ suspicion d’hyperaldostéronisme 54
2-2/ suspicion de phéochromocytome 54
2-3/ suspicion d’hypercorticisme 55
2-4/ suspicion d’hypersécrétion de stéroïdes sexuels 57
2-5/ suspicion d’hypocorticisme 60
3/ la masse est-elle tumorale ? 62
4/ la masse présente-t-elle des signes de malignité ? 62
5/ la masse est-elle une tumeur maligne primitive ou métastatique ? 64
6/ quelle conduite thérapeutique adopter suite à la découverte d’un fortuitome
surrénal ? 65
CONCLUSION 75
BIBLIOGRAPHIE 77
2

INDEX DES FIGURES ET TABLEAUX :
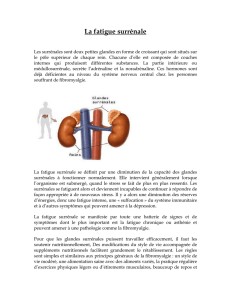
Figure 1 : localisation anatomique des glandes surrénales
Figure 2 : coupe anatomique d’une glande surrénales et sécrétions hormonales
Figure 3 : chaîne de biosynthèse des catécholamines
Figure 4 : régulation de la sécrétion des catécholamines par les cellules de la
médullosurrénale
Figure 5 : chaîne de biosynthèse des gluocorticoïdes, minéralocorticoïdes et stéroïdes
sexuels à partir du cholestérol
Figure 6 : régulation de la sécrétion d’aldostérone par la zone glomérulée du cortex
Figure 7 : principaux effets de l’aldostérone et boucles de régulation
Figure 8 : régulation de la sécrétion de glucocorticoïdes par les zones fasciculée et
réticulée du cortex
Figure 9 : étiologie des masses surrénales
Figure 10 : alignement des diploes placés dans un champs magnétique
Figure 11 : application d’une onde de radiofréquence
Figure 12 : articulations des tests dynamiques lors de suspicion d’hypercorticisme : 1er
cas, masse unilatérale et glande controlatérale de taille normale à diminuée
Figure 13 : articulations des tests dynamiques lors de suspicion d’hypercorticisme : 2°
cas, masse unilatérale et glande controlatérale de taille normale à augmentée ou
atteinte bilatérale
Figure 14 : le fortuitome est-il sécrétant ?
Figure 15 : démarche à rebours après la découverte d’un fortuitome
Figure 16 : proposition de traitement en fonction de la clinique de l’animal et des
données bibliographiques
10
11
12
14
17
19
20
23
25
37
38
58
59
61
66
74
3

15
18
26
28
29
30
38
39
Tableau I : effets physiologiques des catécholamines
Tableau II : facteurs influençant la sécrétion d’aldostérone
Tableau III : principaux symptômes rencontrés lors d’hypercorticisme
Tableau IV : signes cliniques rencontrés lors de phéochromocytome chez le chien
Tableau V : principaux symptômes rencontrés lors d’hypocorticisme et leur
fréquence
Tableau VI : récapitulatif des tableaux cliniques possibles en fonction de la nature
et de la localisation de la masse surrénale
Tableau VII : aspect des différents tissus selon la pondération choisie
Tableau VIII : signaux des différents tissus
Tableau IX : tailles normales des surrénales chez le chien
Tableau X : tailles normales des surrénales chez le chat
Tableau XI : bilan biologique minimal recommandé en médecine humaine suite à
la découverte d’un fortuitome
Tableau XII : bilan biologique minimal de dépistage d’une sécrétion surrénale
anormale et examens complémentaires spécifiques proposés lorsqu’une anomalie
est détectée
Tableau XIII : relation entre la taille de la masse et son caractère bénin ou malin
Tableau XIV : aspects radiographiques en faveur de la malignité ou bénignité de la
masse découverte
Tableau XV : proposition de traitement en fonction de la clinique de l’animal et
des données bibliographiques
42
42
52
60
63
64
73
4
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
1
/
90
100%