Chimie moléculaire

2C6142
Ecole Normale Supérieure de Cachan
Second concours – Admission en Cycle Master CHIMIE
Session 2016
Épreuve de Chimie organique
Durée : 3 heures
« Aucun document n’est autorisé »
« Aucun dictionnaire n’est autorisé »
L’usage de calculatrice électronique de poche à alimentation autonome, non
imprimante et sans document d’accompagnement, est autorisé selon la
circulaire n°99018 du 1er février
1999. De plus, une seule calculatrice est admise sur la table, et aucun
échange n’est autorisé entre les candidats.
Si, au cours de l’épreuve, un candidat repère ce qui lui semble être une erreur
d’énoncé, il le signale sur sa copie et poursuit sa composition en
expliquant les raisons des initiatives qu’il est amené à prendre.

1
CHIMIE ORGANIQUE (3 h)
Préambule
Lorsqu’un mécanisme réactionnel est demandé, le candidat prendra soin de bien mentionner
toutes les espèces mises en jeu ainsi que toutes les étapes de ce mécanisme.
Lorsque la structure d’un composé est demandée, le candidat devra représenter l’intégralité
des atomes présents dans ce composé et faire figurer, par une représentation adéquate, la
stéréochimie de tous les centres stéréogènes.
Liste des abréviations utilisées
AD-mix-alpha : K2OsO2(OH)4 + K3Fe(CN)6 +
K2CO3 + Ligand chiral ((DHQ)2PHAL))
APTS : Acide para-toluènesulfonique
cat. : catalyseur / quantité catalytique
CBS : Catalyseur de Corey-Bakshi-Shibata
CSA : Acide camphorsulfonique
d: doublet
DiBAlH : Hydrure de diisobutylaluminium
DIPEA : Diisopropyléthylamine
DIPT : Diisipropyl tartrate
DMAP : Diméthylaminopyridine
DMF : Diméthylformamide
DMP : Periodinane de Dess-Martin
DMSO : Diméthylsulfoxyde
GP : groupe protecteur
HMDS : Bis(triméthylsilyl)amine
Imid. : Imidazole
LDA : Diisopropylamidure de lithium
m: massif
MOM : Méthoxyméthyle
Ms : Méthanesulfonyle
PPTS : Pyridinium de para-toluène sulfonate
q : quadruplet
rt : Température ambiante
t: triplet
TBAF : Fluorure de tétrabutylammonium
TBDPS : tert-Butyldiphénylsilyle
TBS : tert-Butyldiméthylsilyle
TEMPO : (2,2,6,6-Tétraméthylpipéridin-1-
yl)oxy
Tf : Trifluorométhanesulfonyl
THF : Tétrahydrofurane
Ces dernières années, les mycobactéries, un groupe des protéobactéries qui résident surtout dans le sol,
se sont montrées être une riche source de nouveaux métabolites secondaires. Plusieurs groupes de
recherches ont isolé à partir de mycobactéries, des métabolites secondaires médicalement importants,
tels que l'épothilone, la chondramide, la tubulysine A, et la rhizopodine. Les maltépolides, une classe
de mycobactéries, ont été testés sur un panel de lignées cellulaires transformées et ont montré une
activité cytostatique modérée. Parmi eux, le maltépolide C 1 possède la meilleure activité cytostatique
avec une valeur de CI50 = 2,5 μg.mL-1. Parmi les caractéristiques structurelles importantes des
maltépolides on retrouve une macrolactone à 20 chaînons qui contient soit un motif tétrahydrofurane
soit un époxyde vinylique et une double liaison disubstituée de configuration E.
1. Vers la synthèse du maltépolide C
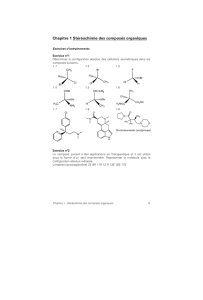
On se propose ici d’étudier la synthèse du maltépolide C 1 à partir des synthons 2 et 3 (Schéma 1).
Seule l’étude du synthon 3 sera réalisée ici, la synthèse du synthon 2 n’étant pas connue à ce jour.

2
Schéma 1 – Rétrosynthèse du maltépolide C 1
Le composé 3 est issu du couplage entre les synthons 4 et 5. Le synthon 4 est préparé en plusieurs
étapes à partir du D-mannitol 6. Le synthon 5 est quant à lui préparé à partir de l’aldéhyde 7
(Schéma 2).
Schéma 2 – Approche rétrosynthétique du fragment 3
a. Préparation du synthon 4
La synthèse du précurseur 4 est réalisée en deux temps, la première partie consiste à préparer
l’intermédiaire 10 (Schéma 3).
Schéma 3 – Synthèse de l’intermédiaire 10
1.1. Représenter le D-mannitol 6 en représentation de Cram.
i. Que signifie la lettre D dans le nom D-mannitol ?
ii. Donner, en justifiant votre réponse, la configuration de tous les centres asymétriques
présents dans le composé 6.
iii. Combien existe-t-il de stéréoisomères pour le composé 6 ?
1.2. Donner, en représentation de Cram, la structure des composés 8, 9, anti-10 et syn-10’.

3
1.3. On précise que lors de la formation des composés 10 et 10’, le composé majoritaire est le
produit anti. Justifier la formation de ce composé majoritaire par l’écriture d’un modèle
approprié.
1.4. Détailler le mécanisme de formation du composé 8 à partir du composé 6.
1.5. Proposer une méthode expérimentale qui permette de déterminer avec précision la proportion
relative des composés 10 et 10’. Expliciter la mise en œuvre de cette méthode.
1.6. Comment préparer le composé syn-10’ majoritairement à partir du composé 9. Justifier votre
réponse.
Pour la suite de la synthèse du synthon 4, on s’intéresse seulement au composé anti-10 (Schéma 4).
Schéma 4 – Synthèse du synthon 4
1.7. Donner la structure des composés 11, 12, 13 et 14.
1.8. Détailler le mécanisme de la transformation de 11 en 12.
1.9. Donner, en infrarouge, les bandes caractéristiques du composé 4.
1.10. Donner le mécanisme de formation du composé 4 à partir du composé 14.
b. Préparation du phosphonate 5
Dans un premier temps, on réalise la synthèse de l’intermédiaire 22 (Schéma 5).
Schéma 5 – Préparation de l’intermédiaire 22
1.11. Proposer les conditions et les réactifs nécessaires pour la synthèse, en deux étapes, de
l’aldéhyde 7 à partir du propane-1,3-diol.
1.12. L’oxazolidinone 15 est préparée à partir de l’aminoacide 23 selon la séquence réactionnelle
suivante :
À une suspension d'aminoacide 23 (200 mmol) dans 300 mL de THF, est ajouté le tétrahydruroborate
de sodium (524mmol), le mélange est alors refroidi à 0°C. Est ensuite additionnée, goutte à goutte, sur
1 heure, une solution de 13 mL d'acide sulfurique concentré dans 26 mL d'éther diéthylique.

4
L'agitation est maintenue 8 heures à température ambiante, avant d'ajouter 19 mL de méthanol et
200 mL d’hydroxyde de sodium à 5 mol/L. Après distillation des solvants, suivie d'un reflux de
2 heures, la solution est extraite au dichlorométhane. La phase organique est séchée sur sulfate de
magnésium anhydre, puis évaporée sous pression réduite pour conduire au composé 23a sous forme
d’un solide blanc.
i. Quel est le réducteur utilisé dans cette réaction ? Justifier.
ii. Quel est le rôle de la solution d’hydroxyde de sodium à 5 mol/L ?
Un mélange de 23a (30 mmol), carbonate de potassium anhydre (3.8 mmol) et de carbonate de
diéthyle (83 mmol) est chauffé à 130 °C, l’éthanol ainsi formé est distillé lentement. Après 6 heures de
réaction le milieu est dilué dans 400 mL de dichlorométhane puis filtré sur un lit de Célite®. La phase
organique est alors lavée deux fois avec 100 mL d’une solution saturée d’hydrogénocarbonate de
sodium puis séchée sur sulfate de sodium anhydre. Le solvant est évaporé sous pression réduite pour
donner le composé 23b sous forme d’un solide jaune pale.
iii. Quel est le but de la filtration sur Célite®.
À une solution de 23b (12 mmol) dans 40 mL de THF refroidi à -78 °C est additionné goutte à goutte
10 mL d’une solution 1.3 mol/L de butyllithium dans l’hexane. Après 10 minutes, le chlorure de
propanoyle (13.6 mmol) est additionné et le milieu est ramené progressivement à l’ambiante. À la fin
de la réaction, le milieu est hydrolysé par une solution saturée de chlorure d’ammonium et extrait au
dichlorométhane. Les phases organiques sont séchées sur sulfate de sodium anhydre et le solvant est
évaporé sous pression réduite, le résidu obtenu est purifié par chromatographie sur gel de silice pour
donner le composé 15 sous forme d’un solide cristallin.
iv. Dans cette dernière transformation, comment peut-on facilement, expérimentalement,
déterminer la fin de la réaction ?
v. Donner la structure des composés 23a et 23b.
vi. Le spectre RMN 1H du composé 15 est enregistré et les valeurs observées sont données
ci-après : 1H NMR (500 MHz, CDCl3) δ 7.35 – 7.12 (m, 5H), 4.81 (tt, J = 7.0, 4.1 Hz,
1H), 4.57 (dd, J = 12.5, 4.1 Hz, 1H), 4.36 (dd, J = 12.5, 4.1 Hz, 1H), 2.94 (dd, J = 12.4,
7.0 Hz, 1H), 2.76 (q, J = 6.8 Hz, 2H), 2.62 (dd, J = 12.5, 7.0 Hz, 1H), 1.24 (t, J = 6.8 Hz,
3H). Attribuer les différents signaux de ce spectre RMN aux protons présents sur la
molécule 15.
1.13. Donner la structure, en précisant leur stéréochimie, des composés 16, 17, 18, 19, 20 et 21.
1.14. Dans le cas de la formation du composé 16 vous représenterez les deux énolates qui peuvent
se former à partir du composé 15.
i. Lequel est majoritaire ? Pourquoi ?
ii. Représenter l’état de transition justifiant la stéréosélectivité observée pour la formation
des composés 16.
iii. Quel est le rôle de l’eau oxygénée dans la formation du composé 16 ?
Le composé 22 est ensuite transformé en synthon 5 (Schéma 6).
 6
6
 7
7
 8
8
1
/
8
100%