Le contrôle de l`activité des enzymes

Le contrôle de l’activité des enzymes
1- Introduction
A- L’opéron lactose
La bactérie s’adapte à son environnement extrêmement rapidement grâce à des opérons. Les ARNm polycistroniques
sont propres aux Procaryotes.
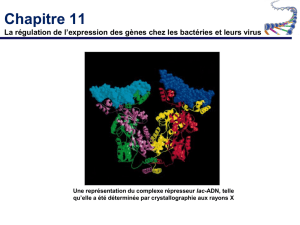
L’opéron lactose est réprimé par un inhibiteur Lac. Ce dernier est désactivé par l’allolactose (produit secondaire du
métabolisme du lactose).
L’opéron possède trois gènes : Z (β-galactosidase), Y (perméase) et A (thiol….).On mime l’action du lactose par l’IPTG
(isopropylthiogalactoside).
On trouve également un autre message : l’AMPc qui reflète indirectement de façon inverse la quantité de glucose
intracellulaire. Une faible quantité de glucose est traduite par une forte concentration en AMPc, qui va aller se fixer
sur une protéine activatrice de la transcription de l’opéron : la CAP (catalbolite activator protein). Il faut être en
présence de lactose et en absence de glucose pour que la transcription soit faite.
B- L’opéron tryptophane
L’opéron tryptophane : le tryptophane exerce un rétrocontrôle négatif sur son opéron lorsqu’il se fixe sur le
répresseur de ce dernier : arrêt de la transcription de l’opéron.
C- Induction de la glutamine synthase
En amont du gène on trouve des séquences enhancers. Sur ces séquences vont se fixer des protéines en état
phosphorylé (NtrC) qui sont phosphorylé par une kinase (NtrB) elle-même activée par la glutamine.
D- Les cytochromes P450
Ils jouent un rôle important dans les hépatocytes qui permettent de transformer des molécules (médicaments ou
aliments). Ils sont sous le contrôle de dimères, si un des dimères a fixé une molécule de substrat.
2- Mécanisme de dégradation des protéines
A- Proteasome
La plus part des protéines à durée de vie courte. Le proteasome est bloqué par la lactocystin.
Les protéines vont être ubiquitinilée (signal de mort). Ce peptide de 76 acides aminés doit être activé par fixation
d’un AMP après déphosphorylation d’un ATP. L’ubiquitin va se fixer sur une enzyme puis sur une autre et enfin sur la
cible.
Certains résidus N-terminaux sont associés à des demi-vies lentes, d’autre à des demi-vies courtes. Ce qui participe
également à la stabilité de la protéine sont des signaux de destructions (séquences d’a.a.) ainsi que des
modifications post-traductionnelles (phosphorylation sur certaines séquences comme PES*T = dégradation). Utiliser
pour stabiliser ou déstabiliser des protéines.
Le proteasome (26S) est composé de plusieurs dizaines de protéines différentes. Il est formé de trois complexes
(dont deux identiques) : deux 19S et un 20S. Les deux régulateurs vont enlever les ubiquitins de la protéine qui va
être envoyée dans le protéasomes qui contient des protéases.

B- Le lysosome
Ce sont des organites issus de l’appareil de Golgi qui présentent un pH acide et de nombreuses enzymes de
dégradations (lipases, glycosides hydrolases, protéases et nucléases).
3- Induction, répression : méthodes de mesure de ks et kd
On va mesurer des activités enzymatiques pour déterminer [E]t.
On utiliser des marqueurs radioactives.
En utilisant des inhibiteurs de synthèse protéiques on détermine la demi-vie des enzymes.
4- Régulation par interactions non-covalentes : régulations allostériques
Forme relâchée (active) et forme tendue (inactive). Le passage de l’une à l’autre dépend du changement de
conformation due à des régulateurs allostériques.
5- Régulation par interactions non-covalentes : interactions protéines-protéines
La trypsine est une protéase pancréatique qui est présente dans le duodénum. Il existe une petite protéine qui
possède une grande affinité pour la trypsine et qui inhibe son activité (kd = 10-13 M très affine). Pour décrocher on
utilise l’urée.
Une autre protéase, l’élastase (produite par les granulocytes) va être inhibée par l’α-1-antitrypsine.
La PKA a pour seul modulateur l’AMPc : en absence d’AMPc c’est un tétramère, en présence les deux S.U. régulatrices
sont dissociées des deux S.U. catalytiques qui deviennent actives. Les kinases sont soit des tyrosines kinases (cibles
pour soigner certaines maladies) soit des sérines-tyrosines kinases (dont PKA).
6- Activation par protéolyse
Les précurseurs des enzymes (Zymogène ou proenzymes) vont être clivés pour donner des enzymes fonctionnelles.
7- Activations par modifications covalentes
Le plus grand nombre de modifications est dû à des phosphorylations.
8- Exemple de régulations enzymatiques « intégrées » : le métabolisme du glycogène
Le glycogène est la molécule de réserve des cellules animales, elle est présente
en grande quantité dans les muscles. Les acides gras sont plus riches en énergie
que les sucres mais le cerveau ne peut pas tirer de l’énergie de ces composés.
Les liaisons entre les glucoses sont des liaisons α 1-4. On utilise différentes
enzymes pour produire des glucoses 6-P à partir du glycogène. La phosphorylase
est régulée par des effecteurs allostériques et par l’adrénaline qui possède un
récepteur couplé à une protéine GA qui active l’AMPc synthase et par une
chaine de réaction de phosphorylation va activer l’enzyme.
La glycogène synthase transfert des UDP-glucose pour former les chaines qui compose le glycogène. Sa régulation se
fait par phosphorylation après cascades d’activations d’enzymes.
1
/
2
100%