Transports de Na dans la cochlée de mammifères

Transports de Na dans la cochlée de mammifères
V. Couloigner1,2, O. Sterkers1,2 et E. Ferrary1
1INSERM U.426 et EMI-U 0112, Faculté Xavier Bichat, Université Paris 7, Paris;
2Service d’oto-rhino-laryngologie et de chirurgie cervico-faciale, AP-HP, Hôpital Beaujon, Clichy
Résumé • Summary
L’endolymphe, liquide baignant le pôle apical des cellules
sensorielles de l’oreille interne, est riche en K et pratiquement
dépourvu de Na. Dans la cochlée, différents transports épithé-
liaux impliqués dans le transport transcelullaire de Na du com-
partiment apical endolymphatique vers le compartiment basola-
téral périlymphatique ont été mis en évidence: Na+,K+-ATPase
basolatérale, canaux cationiques non sélectifs, échangeur Na+/H+
et canal sodique épithélial de type ENaC apicaux. Ces transpor-
teurs pourraient jouer un rôle dans certaines situations physiolo-
giques et pathologiques, en particulier lorsque la concentration
endolymphatique de Na est élevée.
Mots-clés: Oreille interne – Epithélium – Endolymphe – ENaC –
Audition – Maladie de Ménière.
Endolymph, the fluid that bathes the apical side of the inner
ear sensory cells, is a K-rich and Na-poor fluid. In the cochlea,
various epithelial transport systems involved in the transport of
Na from the apical endolymphatic to the basolateral perilym-
phatic compartments have been identified: basolateral Na+,K+-
ATPase, apical non selective cationic channels, Na+/H+exchanger,
and ENaC epithelial Na channel. These transporters may be
involved in physiological and pathological processes in which
endolymph Na concentration is high.
Key words: Inner ear – Epithelium – Endolymph – ENaC – Hearing
– Ménière’s disease.
mise au point
Néphrologie Vol. 23 n° 6 2002, pp. 245-247 245
■Compartiments liquidiens de l’oreille
interne
Les trois organes de l’oreille interne sont la cochlée, dévolue
à l’audition, le vestibule, dévolu à l’équilibration, et le sac endo-
lymphatique, dépourvu de cellules sensorielles et essentiellement
impliqué dans l’homéostasie liquidienne et la défense immuni-
taire de l’oreille interne.
Les deux liquides de l’oreille interne sont la périlymphe et
l’endolymphe. Ces liquides transmettent les stimuli auditifs
(ondes pressionnelles) et vestibulaires (accélérations linéaires et
angulaires) aux cellules sensorielles cochléo-vestibulaires ou cel-
lules ciliées. Par ailleurs, l’endolymphe, du fait de sa composition
originale (voir ci-dessous), joue un rôle essentiel dans la trans-
duction mécano-électrique, processus par lequel les cellules
ciliées transforment le stimulus sensoriel, auditif ou vestibulaire,
en influx nerveux.
●La périlymphe
Le compartiment périlymphatique est compris entre le laby-
rinthe membraneux, épithélium neuro-sensoriel de l’oreille
interne, et le labyrinthe osseux. Dans la cochlée, ce comparti-
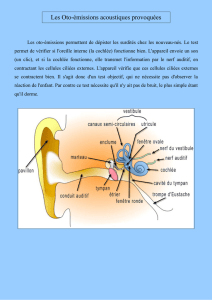
ment se divise en scala vestibuli et scala tympani (fig. 1). La péri-
lymphe baigne le pôle basolatéral des cellules ciliées. Sa compo-
sition est semblable à celle du liquide interstitiel (pour revue, voir 1).
Elle est sécrétée à partir du plasma à travers la barrière hémato-
périlymphatique.2Les structures épithéliales impliquées dans la
sécrétion de la périlymphe ne sont pas connues.
●L’endolymphe
L’endolymphe est située au contact du pôle apical des cel-
lules ciliées (fig. 1). Elle est sécrétée à partir de la périlymphe.3Sa
composition électrochimique est unique parmi les liquides extra-
cellulaires des mammifères (fig. 1) (pour revue, voir 1,4). Elle est
riche en K (170 mM) et en Cl (130 mM), pratiquement dépour-
vue de Na (1-5 mM) et hyperosmolaire de 30 à 40 mosm/l par
rapport au plasma et à la périlymphe. L’hyperosmolarité est liée
aux sels de potassium, la concentration de protéines est extrê-
mement faible. Le pH est de 7,4 et le potentiel transépithélial de
part et d’autre du labyrinthe membraneux est positif dans l’en-
dolymphe. Dans la cochlée, ce potentiel, appelé potentiel endo-
cochléaire, est d’environ + 80 mV.
■Transports de K dans la cochlée
A l’état stationnaire, la stabilité de la concentration de K dans
l’endolymphe cochléaire résulte d’un équilibre entre une sécrétion
et une réabsorption de K s’effectuant toutes deux par voie trans-
cellulaire. La sécrétion de K se fait au travers de l’épithélium de la
strie vasculaire (fig. 1) (pour revue, voir 1,4). Dans les cellules margi-
nales de la strie vasculaire, elle se fait par l’action couplée de deux

transporteurs basolatéraux, la Na+,K+-ATPase et le cotransport
Na-K-2Cl, et d’un canal potassique apical, le canal KvLQT1/IsK.
La réabsorption du K se fait essentiellement à travers les canaux
de transduction mécano-électrique situés dans la membrane api-
cale des cellules ciliées.5
■Transports de Na dans la cochlée
Le gradient électro-chimique de Na de part et d’autre du laby-
rinthe membraneux cochléaire est en faveur d’un flux transépithé-
lial passif de Na vers l’endolymphe. A l’état stationnaire, ce flux
doit être compensé par une réabsorption transcellulaire de Na fai-
sant intervenir des systèmes de transport actif. Cette hypothèse
est étayée par l’augmentation de la concentration endolympha-
tique de Na observée lorsque les systèmes de transports actifs sont
inhibés, par exemple au cours de l’anoxie expérimentale.6
Les transporteurs possiblement impliqués dans la réabsorp-
tion transépithéliale de Na ont été détectés par immunohistochi-
mie, hybridation in situ et « patch-clamp » sur cellules isolées.
L’extrusion de Na vers le compartiment basolatéral du labyrinthe
membraneux s’effectue, au moins en partie, via la Na+,K+-ATPase
basolatérale. En effet, la perfusion périlymphatique d’ouabaïne,
inhibiteur spécifique de la Na+,K+-ATPase, entraîne une augmen-
tation de la concentration endolymphatique de Na.7La Na+,K+-
ATPase est présente dans tous les types cellulaires épithéliaux
bordant l’endolymphe. Parmi ces cellules, les plus intensément
marquées par des anticorps anti-Na+,K+-ATPase sont les cellules
marginales de la strie vasculaire et les cellules du sulcus externe
(fig. 1).8Les transporteurs membranaires apicaux possiblement
impliqués dans l’entrée de Na dans la cellule à partir du compar-
timent endolymphatique sont:
• des conductances cationiques non sélectives dans les cellules
marginales de la strie vasculaire, les cellules du sulcus externe et
celles de la membrane de Reissner.9-11 Cependant, compte tenu des
concentrations respectives de Na et de K dans l’endolymphe, il est
probable que ces canaux transportent préférentiellement du K ;
• l’isoforme NHE3 de l’échangeur Na/H dans les cellules margi-
nales de la strie vasculaire;12
• le canal sodique de type épithélial (ENaC) dans la strie vascu-
laire, la partie basse du mur latéral de la cochlée (proéminence
spirale et/ou sulcus externe), les cellules de Claudius, les cellules
de Deiters et le limbus spiral (fig. 1).13,14
■Rôle de l’ENaC dans la physiologie
et la physiopathologie cochléaires
Ce rôle a été étudié in vivo chez le cochon d’Inde par mesure
du potentiel endocochléaire après injection endolymphatique
d’inhibiteurs de l’ENaC, amiloride et benzamil. En l’absence de
modifications de la composition de l’endolymphe, l’administra-
tion locale de ces inhibiteurs n’altère pas le potentiel endo-
cochléaire. En revanche, lorsqu’une perfusion endolymphatique
d’une solution riche en Na est réalisée, les inhibiteurs de l’ENaC
induisent une augmentation du potentiel endocochléaire proba-
blement due à une inhibition de la réabsorption de Na.13
Sur le plan physiologique, l’ENaC pourrait être particulière-
ment actif en période périnatale lorsque l’endolymphe s’apauvrit
en Na et s’enrichit en K.15 En faveur de cette hypothèse, l’expres-
sion de l’ENaC, évaluée chez le rat par hybridation in situ,
devient maximale à J12, période à laquelle la concentration de
Na dans l’endolymphe diminue le plus.14
En pathologie humaine, il n’a pas été décrit de surdités au
cours du syndrome de Liddle (mutations de l’ENaC avec augmen-
tation de fonction) ou du pseudo-hypo-aldostéronisme de type II
(mutations de l’ENaC avec perte de fonction). Au cours de la
maladie de Ménière, syndrome évoluant par crises et associant
vertiges, surdité de perception et acouphènes, l’ENaC pourrait
être activé. La principale lésion histologique observée dans cette
pathologie est un hydrops endolymphatique, augmentation du
volume du compartiment endolymphatique. Les crises de la mala-
die de Ménière ont été attribuées à la rupture du labyrinthe mem-
braneux distendu, à l’origine d’une contamination de l’endo-
lymphe par du Na.16 Dans cette pathologie, l’activation de l’ENaC
pourrait permettre la clairance du Na hors de l’endolymphe.
En conclusion, le maintien d’une faible concentration de Na
dans l’endolymphe est nécessaire au bon fonctionnement des cel-
lules sensorielles cochléo-vestibulaires. Plusieurs systèmes de trans-
ports localisés dans différentes portions de l’épithélium labyrin-
thique cochléaire participent à la réabsorption de Na en dehors du
compartiment endolymphatique. Parmi ces transporteurs, l’ENaC
pourrait avoir un rôle prédominant, en particulier durant le déve-
loppement et au cours de certaines pathologies de l’oreille interne.
mise au point
Néphrologie Vol. 23 n° 6 2002
246
CCI
CCE
THC
DDD
Scala vestib uli
Périlymphe:
K = 5 mM; Na = 140 mM
Limbus
spiral
Scala media
Endolymphe
K = 170 mM; Na = 1 mM
Strie
vasculaire Os temporal
Vaisseau sanguin
Sulcus
externe
Proéminence
spirale
Ligament
spiral
Scala tympani
Périlymphe:
K = 5 mM; Na = 140 mM
Fig. 1 : Représentation schématique d’une coupe de cochlée avec
agrandissement de l’organe de Corti.
Latéralement, le ligament spiral et la strie vasculaire constituent le mur
latéral. L’organe de Corti comprend une rangée de cellules ciliées internes
(CCI) et plusieurs rangées de cellules ciliées externes (CCE) soutenues par
les cellules de Deiters (D). Plus latéralement se trouvent les cellules tectales
(T), les cellules de Hensen (H) et les cellules de Claudius (C).

Remerciements
Les auteurs tiennent à exprimer leur gratitude au Pr Gérard
Friedlander pour son soutien. Ils remercient Nicolette Farman et
les membres de l’unité INSERM U.478 pour leur aide à la réalisa-
tion de ce travail sur le canal ENaC.
Financement
Cette étude a été financée par l’INSERM, la Faculté Xavier
Bichat et l’Université Paris 7. Vincent Couloigner a bénéficié d’un
financement de la Fondation pour la Recherche Médicale pour
l’année de DEA et d’un poste d’accueil INSERM pour les trois
années de thèse
Adresse de correspondance:
Dr Evelyne Ferrary
INSERM EMI-U 0112
Faculté Xavier Bichat
Boîte postale 416
16, rue Henri Huchard
F-75870 Paris Cedex 18
E-mail: [email protected]
1. Sterkers O, Ferrary E, Tran Ba Huy P. Production des liquides de l’oreille
interne. Med Sci 1990; 6: 755-61.
2. Sterkers O, Ferrary E, Saumon G, Amiel C. Na and nonelectrolyte entry
into inner ear fluids of the rat. Am J Physiol 1987; 253 : F50-F8.
3. Sterkers O, Saumon G, Tran Ba Huy P, Amiel C. K, Cl, and H2O entry in
endolymph, perilymph, and cerebrospinal fluid of the rat. Am J Physiol
1982; 243 : F173-F80.
4. Ferrary E, Sterkers O. Mechanisms of endolymph secretion. Kidney Int
1998; 65 (Suppl.) : S98-103.
5. Hudspeth AJ. The cellular basis of hearing: the biophysics of hair cells.
Science 1985; 230 : 745-52.
6. Bosher SK. The nature of the negative endocochlear potentials produced
by anoxia and ethacrynic acid in the rat and guinea-pig. J Physiol (Lond)
1979; 293 : 329-45.
7. Konishi T, Mendelsohn M. Effect of ouabain on cochlear potentials and
endolymph composition in guinea pigs. Acta Otolaryngol 1970; 69 : 192-9.
8. Nakazawa K, Spicer SS, Schulte BA. Ultrastructural localization of Na,K-
ATPase in the gerbil cochlea. J Histochem Cytochem 1995 ; 43: 981-91.
9. Yeh T, Van den Abbeele T, Marianovski R, Herman P, Tran Ba Huy P. Lumi-
nal non-selective cation and outwardly rectifying chloride channels in cul-
tured strial marginal cells from gerbil. Hear Res 1995; 90 : 79-88.
10. Yeh TH, Herman P, Tsai MC, Tran Ba Huy P, Van Den Abbeele T. A cationic
nonselective stretch-activated channel in the Reissner’s membrane of the
guinea pig cochlea. Am J Physiol 1998; 274 : C566-C76.
11. Marcus DC, Chiba T. K+and Na+absorption by outer sulcus epithelial
cells. Hear Res 1999; 134 : 48-56.
12. Bond BR, Ng LL, Schulte BA. Identification of mRNA transcripts and
immunohistochemical localization of Na/H exchanger isoforms in gerbil
inner ear. Hear Res 1998 ; 123: 1-9.
13. Couloigner V, Fay M, Djelidi S, Farman N, Escoubet B, Runembert I, Ster-
kers O, Friedlander G, Ferrary E. Location and function of the epithelial Na
channel in the cochlea. Am J Physiol Renal Physiol 2001; 280 : F214-22.
14. Gründer S, Müller A, Ruppersberg JP. Developmental and cellular expres-
sion pattern of epithelial sodium channel alpha, beta and gamma sub-
units in the inner ear of the rat. Eur J Neurosci 2001; 13 : 641-8.
15. Anniko M, Sobin A, Wroblewski R. X-ray microanalysis of inner ear fluids
in the embryonic and newborn guinea pig. Arch Otorhinolaryngol 1982;
234: 125-10.
16. Merchant SN, Rauch SD, Nadol JB Jr. Meniere’s disease. Eur Arch Otorhi-
nolaryngol 1995; 252 : 63-75.
mise au point
Néphrologie Vol. 23 n° 6 2002 247
Références
1
/
3
100%