Corrigé Commentaire Correspon Corrigé

application I: sélectivité en chimie organique
248tPARTIE 3 AGIR
3 Sélectivité
en chimie organique
(p. 501)
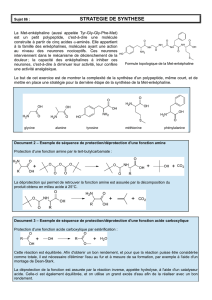
Objectif
Par l’analyse d’un document, l’élève est amené à
utiliser la notion de réactif chimiosélectif dans le
cas de réduction en chimie organique. L’un des réac-
tifs est le borohydrure de sodium NaBH4 qui réduit
de façon sélective les cétones et pas les ester, qu’il
devra comparer à l’autre réactif, l’aluminohydrure
de lithium LiAlH4, qui réduit ces deux fonctions.
Correspondance avec le programme
Extraire et exploiter des informations sur l’utilisa-
tion de réactifs chimiosélectifs pour mettre en évi-
dence le caractère sélectif ou non d’une réaction.
Corrigé
a.
O
O
HO
O
A
b. Pour obtenir le produit B, seule la fonction
cétone a été réduite en alcool, l’ester n’a pas été
transformé. Il faut donc utiliser NaBH4. Pour obte-
nir le produit C, dans lesquels les 2 groupes carac-
téristiques de A ont été réduits en hydroxyde, il
faut utiliser LiAlH4.
c. La réaction de A, qui possède plusieurs groupes
caractéristiques susceptibles d’être réduits, en B ne
transforme qu’un seul des groupes caractéristique.
Elle est donc sélective. Ce n’est pas le cas de la
transformation de A en C.
d. En utilisant LiAlH4, le chimiste peut réduire l’es-
ter en alcool pour effectuer la transformation de B
en C.
e. En effectuant le spectre IR, le chimiste s’assure
de l’absence de bande C== O qui apparaîtrait dans
la région 1 600 à 1 800 cm−1. Il ne peut donc pas
s’agir du produit B, il y a donc de forte chance pour
qu’il s’agisse bien du produit C.
Commentaire
Pour aller plus loin, des variations avec d’autres
composés donneurs d’hydrure, réduisant sélective-
ment les dérivés d’acides.
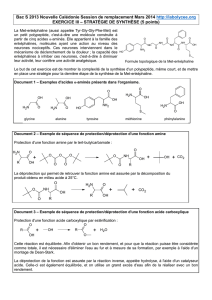
4 Protection de fonction dans
la synthèse peptidique
(p. 502)
Objectif
Cette activité démontre la nécessité de la pro-
tection pour obtenir un enchaînement contrôlé
d’acides aminés. Pour simplifier une situation déjà
compliquée, les acides aminés sont assimilés à des
composés bifonctionnels (amine/acide carboxy-
lique), c’est-à-dire que l’on ne s’intéresse pas à la
nature des chaînes latérales. L’élève commence à
raisonner avec le cas simple d’un dipeptide. Ensuite
les problèmes qui peuvent se poser lors de l’aug-
mentation de la chaîne sont abordés, ainsi que la
notion de déprotection sélective pour libérer soit
l’amine soit l’acide carboxylique.
Correspondance avec le programme
Extraire et exploiter des informations sur la pro-
tection d’une fonction dans le cas de la synthèse
peptidique pour mettre en évidence le caractère
sélectif ou non d’une réaction.
Corrigé
a. Dipeptide Ala-Gly :
H2NCH
CH3
C
O
NH CH2C
O
OH
Dipeptide Gly-Ala :
H2NCH2C
O
NH CH C
O
OH
CH
3
Dipeptide Gly-Gly :
H
2
NCH
2
C
O
NH CH
2
C
O
OH
Dipeptide Ala-Ala :
H2NCH C
O
NH CH C
O
OH
CH
3
CH
3
Remarques :
tLes propriétés de Gly-Ala et Ala-Gly sont dis-
tinctes : il est important de souligner qu’il ne s’agit
absolument pas de la même molécule.
tLes composés formés d’un faible nombre d’acides
aminés sont également appelés « oligopeptides ».
1

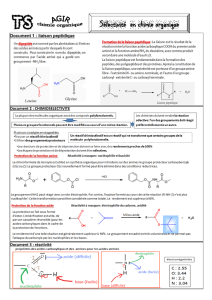
application II: synthèse peptidique
1 a. Dipeptides obtenus :
NH
O
NH2Leu-Gly
OH
O
NH2
Gly-Leu
OH
O
HN O
H2N
H2NNH
O
OH
O
Leu-Leu Gly-Gly
OH
O
HN O
b. Les deux fonctions de la leucine et de la glycine
peuvent réagir, donc la synthèse est non sélective.
2 a. Les sites accepteurs sont notés δB et sites
donneurs notés δv :
O
N
H
O
H H
N
O
H
H
H
O
δv
δvδv
δv
δv
δv
δBδBδB
δBδB
δB
δB
δB
δBδB
b. Sites devant réagir :
O
N
H
O
H H
N
O
H
H
H
O
δv
δB
c. Mécanisme de la première étape :
O
NH2
OH H2N
O
OH
3 La réaction entre un acide carboxylique et une
amine est lente. On active la fonction acide carboxy-
lique pour augmenter la vitesse de la réaction.
Si l’une des deux fonctions acide carboxylique est
activée, la deuxième est rarement protégée en pratique
(cela n’est pas nécessaire).
Complément
4 On ne peut pas protéger la fonction amine en
créant une fonction amide, car, lors de l’étape de
déprotection, on casserait aussi la liaison peptidique.
5 Le fait de pouvoir enlever les deux groupes pro-
tecteurs dans des conditions différentes est utile
si on ne veut pas s’arrêter au stade dipeptide. En
effet, si on veut ajouter l’acide α-aminé alanine,
par exemple, on pourra synthétiser Ala-Leu-Gly ou
Leu-Gly-Ala selon la fonction chimique qui a été
déprotégée.
6 a. Pour synthétiser Pro-Leu-Gly il faudra déproté-
ger la fonction amine de la leucine.
b. Formule topologique du tripeptide Pro-Leu-Gly :
OH
O
Pro-Leu-Gly
NH
O
HN
NH
O
c. La fonction acide carboxylique de la glycine étant
déjà protégée, il faut protéger la fonction amine de
la proline (pour éviter Pro-Pro) et activer la fonction
acide carboxylique de la proline.
7 a. Il y a six étapes pour cette synthèse : deux pro-
tections, une activation, le couplage et deux dépro-
tections, ce qui fait un rendement :
η = 0,906 = 0,53 = 53 %.
b. Dans le cas d’un polypeptide composé de
dix acides α-aminés (41 étapes), le rendement tombe
à 1,3 %.
c. En utilisant un polymère insoluble, on simplifie les
étapes de séparation et de purification, car le poly-
peptide reste accroché au support solide, ce qui aug-
mente le rendement de chaque étape (une simple fil-
tration suffit) et donc le rendement global.
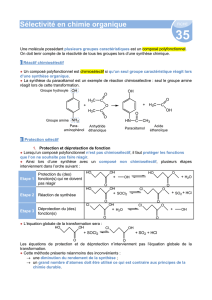
8 Un groupe protecteur est un groupe caractéris-
tique, volontairement créé dans une molécule poly-
fonctionnelle afin de bloquer la réactivité de l’une
de ses fonctions. Cette fonction est temporairement
transformée en une autre fonction.
Le groupe protecteur utilisé doit réagir de manière
sélective avec la fonction à protéger, être stable lors
des réactions suivantes et pouvoir être enlevé (clivé)
facilement et de manière sélective, une fois la réac-
tion effectuée.
L’utilisation d’un groupe protecteur nécessite au
moins deux étapes supplémentaires dans une syn-
thèse. Il faut donc que les étapes de protection et
de déprotection aient lieu avec de très bons ren-
dements.
2
1
/
2
100%