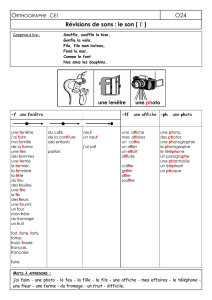
VI LES GAZ, partie D

Chapitre VI Les gaz, partie D : Exercices page i/iii
VI LES GAZ, partie D
Les exercices de niveau A servent à mémoriser les notions de base du cours : vitesse
quadratique moyenne, énergie cinétique de translation brownienne et énergie interne d’un
gaz parfait.
L’exercice de niveau C demande de maîtriser le calcul de la pression cinétique en
l’appliquant à celui de la pression exercée par la pluie sur une fenêtre.
Exercices de niveau A
Exercice VI-A1
a. Rappeler l’expression de la vitesse quadratique moyenne des molécules d’un gaz parfait
en équilibre thermodynamique à la température T.
b. Exprimer cette vitesse en fonction de la pression p et de la masse volumique µ.
c. En assimilant l’air { un gaz parfait unique, calculer sa vitesse quadratique moyenne dans
les conditions normales de température et de pression. Sa masse volumique est alors
µ0 = 1,293 kg.m-3.
a. La vitesse quadratique moyenne des molécules
d’un gaz parfait en équilibre thermodynamique à la
température T s’écrit :
3RT
CM
b. D’après l’équation d’état des gaz parfaits, écrite
pour une mole de gaz :
m
RT pV
D’après la définition de la masse volumique :
m
MV
En remplaçant dans la vitesse quadratique
moyenne :
3p
C
c. Le calcul numérique donne :
11
5
x3 1,013.10 m.s 484,8 m.s
1,293
C
La vitesse quadratique moyenne des molécules de
l’air (essentiellement diazote et dioxygène) est
d’environ 500 m.s-1.
Exercice VI-A2
a. Calculer la vitesse quadratique moyenne des molécules d’hélium, considéré comme un
gaz parfait, à la température t = 20°C.
b. Calculer l’énergie cinétique moyenne { cette température d’une mole d’hélium.
c. Calculer la vitesse quadratique moyenne des molécules de diazote considéré comme un
gaz parfait, à la température t = 20°C.
d. Calculer l’énergie cinétique moyenne de translation brownienne à cette température
d’une mole de diazote.
Données : M(He) = 4 g.mol-1, M(N) = 14 g.mol-1, R = 8,314 J.K-1.mol-1.
a. La vitesse quadratique moyenne de l’hélium à
20 °C vaut :
11
3
xx
3
3 8,314 293 m.s 1,35 km.s
4.10
RT
CM
C
b. En notant m la masse d’une molécule, l’énergie
cinétique moyenne d’une mole d’hélium à cette
température vaut :
22
x
113
2 2 2
38,314 293 J 3,65 kJ
2
KA
K
E C MC RT
E
Nm

Chapitre VI Les gaz, partie D : Exercices page ii/iii
c. La vitesse quadratique moyenne du diazote à
20 °C vaut :
11
3
xx3 8,314 293 m.s 511m.s
28.10
C
Les molécules de diazote sont plus massives que
celles d’hélium. Elles sont donc en moyenne plus
lentes. Les vitesses quadratiques moyennes sont
de l’ordre de quelques centaines à un millier de
mètres par seconde.
d. L’énergie cinétique moyenne de translation
brownienne d’une mole de diazote à cette
température vaut :
x
38,314 293 J 3,65 kJ
2
K
E
Le diazote est un gaz diatomique tandis que
l’hélium est monoatomique. Mais leur énergie
cinétique de translation brownienne ne dépend
que de la température. Cette énergie est de l’ordre
du kilojoule par mole.
Exercice VI-A3
a. Calculer l’énergie interne d’une masse m = 0,8 g d’hélium, considéré comme un gaz
parfait, à la température t =20°C. Puis calculer la variation d’énergie interne de ce
système entre les températures de 20°C et 40°C.
b. Calculer l’énergie interne d’une masse m = 5,6 g de diazote, considéré comme un gaz
parfait, à la température t =20°C. Puis calculer la variation d’énergie interne de cette
masse entre les températures de 20°C et 40°C.
c. Comparer les résultats concernant l’hélium et le diazote.
Données : M(He) = 4 g.mol-1, M(N) = 14 g.mol-1, R = 8,314 J.K-1.mol-1.
a. L’énergie interne de l’hélium, gaz parfait
monoatomique, vaut :
x
33
22
0,8 3 8,314 293 J 731 J
42
m
U n RT RT
M
U
La variation d’énergie interne vaut :
21
x
33
22
0,8 3 8,314 40 20 J 50 J
42
m
U n R T R T T
M
U
b. Les températures considérées sont des
températures usuelles donc l’énergie interne du
diazote, gaz parfait diatomique, vaut :
55
22
m
U n RT RT
M
x
5,6 5 8,314 293 J 1,22 kJ
28 2
U
La variation d’énergie interne vaut :
21
x
55
22
5,6 5 8,314 40 20 J 83 J
28 2
m
U n R T R T T
M
U
c. Les masses d’hélium et de diazote considérées
correspondent à la même quantité de matière,
0,2 mol. L’hélium et le diazote n’ont cependant pas
la même énergie interne car le premier est
monoatomique et le second diatomique. Ces
énergies internes sont de l’ordre du kilojoule par
mole.
Exercice de niveau C
Exercice VI-C1
La pluie tombe sur une fenêtre verticale d’aire S = 3 m2. Elle tombe constamment sous un angle
θ = 20° par rapport à la verticale et avec une densité ng = 1000 gouttes identiques par m3.
Chaque goutte possède une vitesse v = 2 m.s-1 et une masse m = 0,1 g et rebondit sur la fenêtre
élastiquement.
Indications : Le volume d’un cylindre oblique est égal { la surface de base multipliée par la
hauteur mesurée perpendiculairement aux bases. On relira avec profit le paragraphe D. du
chapitre VI et on lira également avec profit le complément VI.2, en particulier les paragraphes
3.c. & 4.
a. Combien de gouttes rebondissent sur la fenêtre en une durée Δt = 1 s ?

Chapitre VI Les gaz, partie D : Exercices page iii/iii
b. Exprimer littéralement la force exercée par ces gouttes sur la fenêtre.
c. Exprimer littéralement la pression exercée par ces gouttes sur la fenêtre.
d. La calculer numériquement.
a. Les gouttes qui frappent la fenêtre entre deux
instants de dates t et t+Δt se trouvent à l’instant de
date t dans le cylindre oblique de base S et de
longueur v Δt. Voir figure 1. La hauteur de ce
cylindre, mesurée perpendiculairement aux bases,
vaut v Δt sinα. Le nombre de gouttes cherché vaut
donc :
sin
g
N n Sv t
1000.3.2.1.sin20 2052N
b. D’après la loi des interactions réciproques, la
force exercée par une goutte sur la fenêtre est
l’opposée de la force exercée par la fenêtre sur la
goutte :
goutte/fenêtre fenêtre/goutte
ff
D’après la loi fondamentale de la Dynamique, la
force exercée par la fenêtre sur une goutte vaut :
goutte goutte
fenêtre/goutte
choc choc
p mv
ftt
La variation de quantité de mouvement d’une
goutte s’exprime en fonction de ses vitesses avant
et après le choc. Voir figure 2 :
goutte après avant
goutte
goutte 2 2 sin
x y x y
x
p mv mv
p m v v m v v
p mv mv i
D’où l’expression de la force exercée par la goutte
sur la fenêtre :
goutte/fenêtre
choc
2 sinmv
fti
La force moyenne équivalente s’exerçant pendant
la durée Δt vaut :
goutte/fenêtre
2 sinmv
fti
La force moyenne exercée par les N gouttes vaut
donc :
22
gouttes/fenêtre goutte/fenêtre
gouttes/fenêtre
gouttes/fenêtre
2 sin
sin
2 sin
g
g
F N f
mv
F n Sv t t
F n Smv i
i
c. La pression est le quotient de l’intensité de la
force pressante par l’aire de la surface pressée :
gouttes/fenêtre
F
pS
2
2
2 sin
2.1000.0,1 2sin 20 Pa
23 Pa
g
p n m v
p
p
C’est une très faible pression, équivalente à celle
exercée par le poids d’une masse d’environ 2,3 kg
répartie sur 1 m2.
fenêtre S
distance v t = v t sin
x
pluie
Figure 1 : Dénombrement des gouttes
xx'
vavant
vaprès
vx avant
vy avant
y'
y
Figure 2 : Un choc élastique
1
/
3
100%